LE “IMPRONTE” DELLA FIBROMIALGIA NEL CERVELLO: RUOLO DELLA DIAGNOSTICA PER IMMAGINI NELLA CARATTERIZZAZIONE NEUROFISIOLOGICA DEL DOLORE CRONICO
AUTORI:
Fausto Salaffi1, Marina Carotti2, Gabriele Polonara2, Sonia Farah1, Andrea Giovagnoni2
Introduzione
L’attivazione delle cellule gliali è stata invocata come fattore causale nello sviluppo e nel mantenimento del dolore cronico. Tale meccanismo può spiegare sindromi da sensibilizzazione centrale con amplificazione del dolore e presenza di una generalizzata allodinia ed iperalgesia, come la fibromialgia. Così come ha un ruolo chiave nello sviluppo del dolore cronico, evidenze crescenti suggeriscono che la neuroinfiammazione sia una causa alla base di molte malattie del sistema nervoso centrale (SNC), tra cui la malattia di Alzheimer, la malattia di Parkinson, la sclerosi multipla e numerosi disordini psichiatrici.
La neuroinfiammazione consiste in una complessa cascata di eventi biologici attraverso la quale, a partire dall’attivazione della microglia, si produce uno stato infiammatorio che persiste oltre la normale durata fisiologica, provocando una condizione patologica progressiva. La cosìdetta “attivazione gliale” sembra essere alla base della genesi e della modulazione del dolore cronico in corso di fibromialgia. L’attivazione delle cellule di Schwann nel nervo, delle cellule gliali satelliti nei gangli, della microglia, degli astrociti e degli oligodendrociti nel midollo spinale e nel cervello èsostenuta da citochine pro-infiammatorie (TNF, IL-1β, IL-6, IL-8 e IL-18) e da chemochine. Anche gli oppioidi partecipano all’attivazione gliale, non tramite i relativi recettori, ma attraverso l’attivazione del “toll-like receptor 4” o TLR-4, recentemente scoperto sulle cellule macrofagiche e della microglia. E’ dimostrato che il TLR- 4, espresso nel midollo spinale, media la transizione dell’ipersensibilità meccanica da acuta a persistente dopo la risoluzione dell’infiammazione in un modello di artrite nei roditori. Il tumor necrosis factor-alpha (TNF-α) è una delle citochine infiammatorie più studiate e più potenti ed èstato mostrato che è espressa da microglia, astrociti e neuroni sensitivi primari. Tuttavia, vi sono evidenze che nonostante la maggioranza della microglia (90%) ed una minore proporzione di astrociti (40%) esprimano TNF-α, i neuroni del midollo spinale non lo fanno, suggerendo che la microglia èla sorgente maggiore di TNF-α. È interessante notare che la neutralizzazione del TNF-α inibisce il dolore cronico in pazienti con artrite reumatoide molto più velocemente di quanto non migliori i segni d’infiammazione come la riduzione della tumefazione articolare, probabilmente attraverso l’inibizione della neurotrasmissione nocicettiva mediata dal TNF-α (plasticità sinaptica) nelle corna dorsali del midollo spinale prima del miglioramento dell’infiammazione. L’interleuchina-1 beta (IL-1β), un’altra citochina infiammatoria cruciale, èespressa sia dalla microglia che dagli astrociti nel midollo spinale, mentre l’IL-18 – che èstrettamente correlata all’IL- 1β – èindotta nella microglia dopo danno ai nervi ed esposizione cronica agli oppioidi. Le chemochine come CCL2, CCR2, CXCL1 e CCL7 sono prodotte dagli astrociti del midollo spinale e facilitano l’insorgenza ed il mantenimento del dolore neuropatico. In particolare, CCL2 e CCR2 sono coinvolti nelle interazioni di segnale tra i neuroni sensitivi primari e la microglia del midollo spinale nel dolore neuropatico. Il CCR2 è probabilmente il recettore delle chemochine maggiormente studiato nella ricerca sul dolore. Il basic fibroblast growth factor (bFGF) è indotto negli astrociti del midollo spinale per sostenere il dolore neuropatico. Inoltre, le cellule gliali producono citochine antinfiammatorie come IL-4, IL-10, TGF- β ed IFN-α che antagonizzano il dolore, ma la localizzazione cellulare di queste citochine antinfiammatorie non ètuttora ben caratterizzata.
Fisiologia delle cellule gliali e neuroinfiammazione
Per neuroinfiammazione si intende una risposta infiammatoria all’interno del SNC o SNP. L’infiammazione è mediata dalla produzione di citochine, chemochine, specie reattive dell’ossigeno, secondi messaggeri. Tutti questi mediatori sono prodotti dalle cellule gliali del SNC (microglia, astrociti e cellule ependimali). A questa attivazione infiammatoria corrispondono conseguenze fisiologiche, biochimiche e psicologiche.
Microglia. La microglia rappresenta la componente macrofagica residente nel SNC ed è coinvolta nei processi immunitari (Figura 1). Le cellule microgliali rappresentano il 5-10% della popolazione cellulare totale del cervello. E’ una popolazione di derivazione ematopoietica: durante l’embriogenesi, infatti, una sottopopolazione di monociti migra nel sistema nervoso e si differenzia in macrofagi residenti. Le cellule di microglia sono costituite da un piccolo corpo cellulare e da lunghi processi affusolati dotati di lamellipodi che gli conferiscono una morfologia ramificata. Sono diffuse omogeneamente nel parenchima cerebrale e possono ritrovarsi adese ai neuroni, ma anche in prossimitàdi vasi sanguigni e libere nella materia grigia. Queste cellule sono interne alla barriera ematoencefalica e, pertanto, sono pronte a recepire e rispondere a eventuali danni alla barriera stessa. La microglia è normalmente quiescente nel SNC, il soma cellulare resta immobile mentre le ramificazioni si muovono di continuo per monitorare l’ambiente circostante. Il verificarsi di modificazioni dell’omeostasi nell’ambiente, come l’aumento delle proteine seriche, la tossicitàda glutammato, un aumento di purine (ATP, ADP) oppure la presenza di lipopolisaccaride (molecola presente sulla membrana dei batteri GRAM-negativi) sono tutti stimoli in grado di attivare la microglia, mediante recettori e vie del segnale differenti. Le cellule della microglia presenti nelle aree perivascolari esercitano, inoltre, la funzione di cellule presentanti l’antigene (APC) sulle cellule T mielina-specifiche, che si sono infiltrate nel SNC e che possono dare inizio così ai processi infiammatori. Quando la microglia si attiva, passa da una morfologia ramificata ad una ameboide, i lamellipodi si ritraggono e la cellula assume capacitàfagocitica, volta a eliminare eventuali residui di cellule morte o fagocitare batteri e virus. Il processo di attivazione microgliale è un fenomeno complesso, caratterizzato dall’acquisizione di diversi fenotipi funzionali, schematicamente rappresentati dai fenotipi M1 e M2, associati, rispettivamente, a funzioni neuro-tossiche e neuroprotettive (Figura 2).
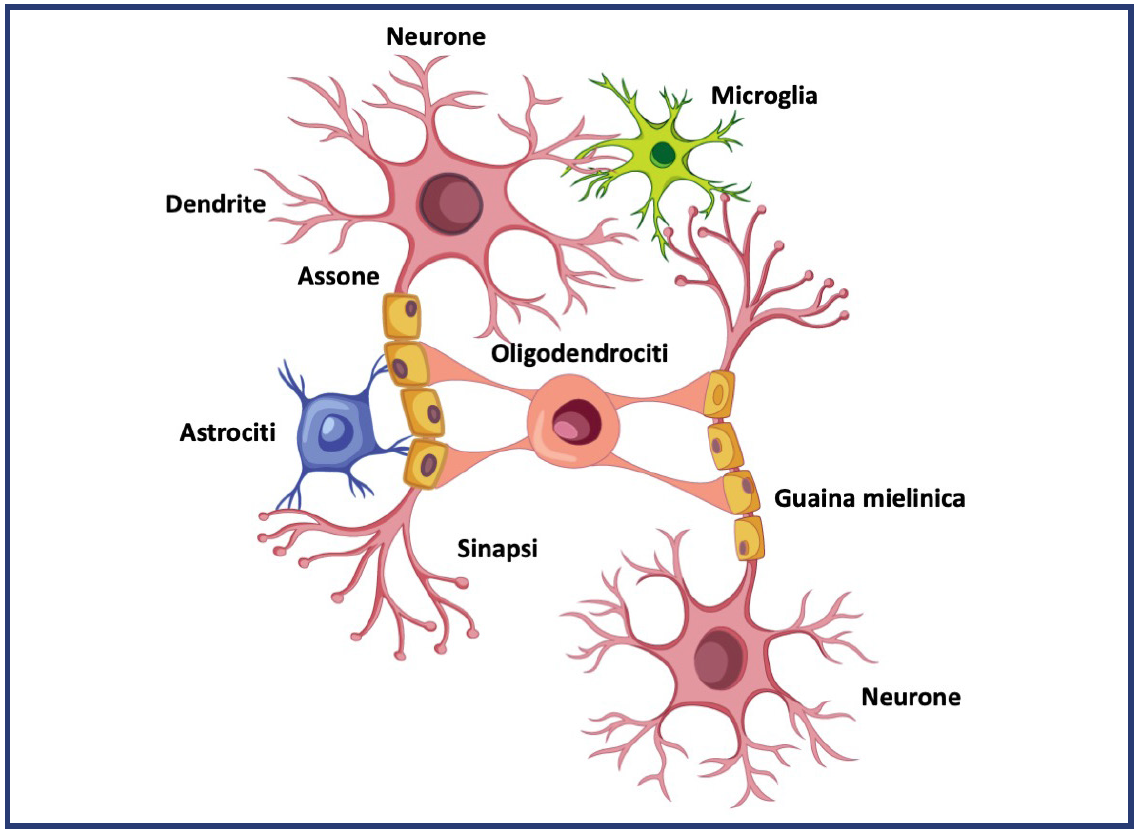 Figura 1. I protagonisti del SNC: interazioni tra la microglia, le altre cellule del sistema immunitario e la rete neuronale
Figura 1. I protagonisti del SNC: interazioni tra la microglia, le altre cellule del sistema immunitario e la rete neuronale
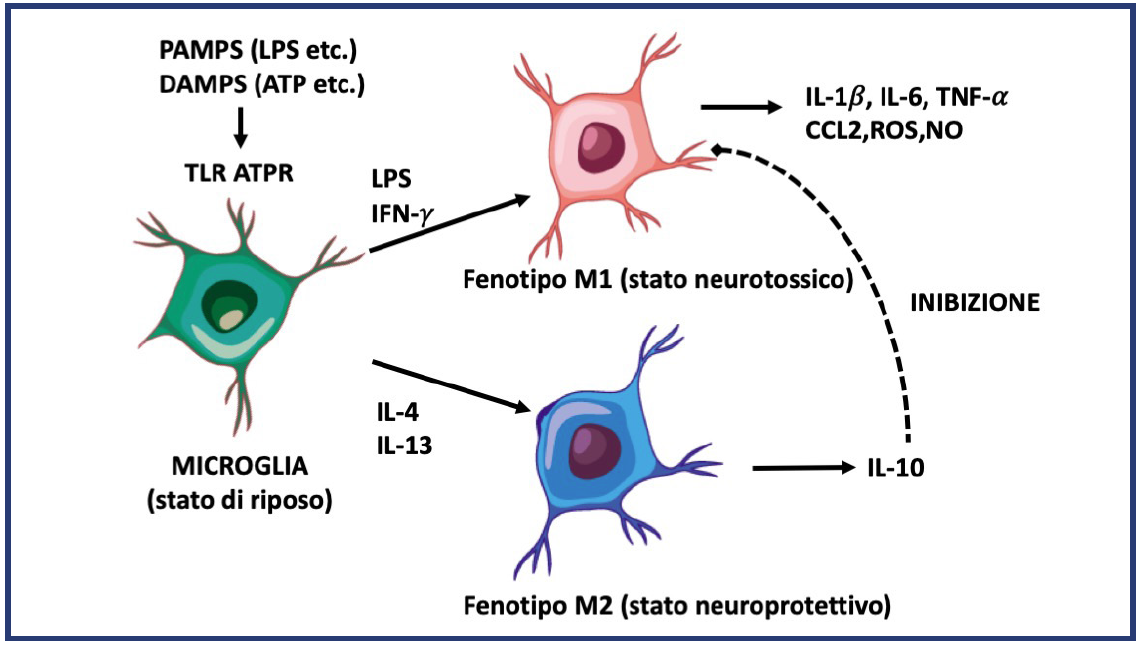 Figura 2. Il processo di attivazione microgliale. L’attivazione microgliale di tipo M1, induce uno stato di “tolleranza infiammatoria”, caratterizzata dalla riprogrammazione di queste cellule verso il fenotipo anti-infiammatorio M2 (modificata da: Nakagawa Y, Chiba K. Role of microglial m1/m2 polarization in relapse and remission of psychiatric disorders and diseases. Pharmaceuticals (Basel). 2014;7(12):1028-489).
Figura 2. Il processo di attivazione microgliale. L’attivazione microgliale di tipo M1, induce uno stato di “tolleranza infiammatoria”, caratterizzata dalla riprogrammazione di queste cellule verso il fenotipo anti-infiammatorio M2 (modificata da: Nakagawa Y, Chiba K. Role of microglial m1/m2 polarization in relapse and remission of psychiatric disorders and diseases. Pharmaceuticals (Basel). 2014;7(12):1028-489).
La microglia attivata ha come ruolo principale quello di promuovere e di sostenere lo stato infiammatorio mediante la produzione di citochine, intermedi reattivi dell’ossigeno, proteinasi, fattori del complemento e chemochine. Tali mediatori infiammatori promuovono l’infiltrazione di cellule del sistema immunitario dal circolo ematico, il richiamo di altre cellule microgliali dalle aree circostanti e l’attivazione degli astrociti. Quando lo stimolo infiammatorio che ha scatenato l’attivazione viene a mancare, la microglia partecipa ai processi di soppressione dello stato infiammatorio con la produzione di citochine immunomodulatorie, come IL-15, e anti-infiammatorie, come IL-10; ritorna poi in stato di inattivazione, oppure va incontro ad apoptosi. La microglia possiede anche una proprietàtrofica, utile a proteggere le cellule neuronali. Tale azione è mediata dalla produzione di fattori di crescita come il glial cell line-derived neurotrophic factor (GDNF), il brain-derived neurotrophic factor (BDNF) e il neural growth factor (NGF). L’attivazione microgliale e gli eventi neuroinfiammatori che ne conseguono sono indirizzati alla neuroprotezione e all’eliminazione della causa della mancata omeostasi. In realtà, sia nelle malattie neurodegenerative a carattere cronico che negli eventi traumatici, come l’ischemia, un’incontrollata e persistente attivazione microgliale può avere effetti neurotossici e concorrere ad esacerbare il danno neuronale. Il bilancio tra azione neuroprotettiva e neurotossica della microglia è determinato da numerosi fattori, tra cui la natura dello stimolo scatenante e le interazioni che si istaurano tra la microglia, le altre cellule del sistema immunitario e la rete neuronale, per cui risulta semplicistico categorizzare il ruolo della microglia in modo assoluto e sono certamente necessari ulteriori studi per far luce sui meccanismi che regolano questo duplice ruolo. Numerose evidenze hanno dimostrano che la modulazione dell’attivazione microgliale, ed in generale dello stato infiammatorio nel cervello, sono in grado di migliorare la sintomatologia di molte condizioni patologiche e di diminuire il fenomeno della neurodegenerazione. Sulla base di tali osservazioni l’attivazione microgliale rappresenta un potenziale target farmacologico per la cura delle malattie neurodegenerative.
Astrociti. Gli astrociti sono cellule caratterizzate da complesse ramificazioni a simmetria radiale che conferiscono loro una forma stellata. Possono essere di tre tipi: astrociti fibrosi; protoplasmatici e radiali. Gli astrociti fibrosi predominano nella sostanza bianca del nevrasse; hanno un piccolo corpo cellulare e sono provvisti di numerosi prolungamenti filiformi a superficie liscia. La caratteristica principale di queste cellule è la presenza nel corpo cellulare e nei prolungamenti di spesse strutture fibrillari, le gliofibrille, che risultano costituite dall’aggregazione di gliofilamenti piùsottili. I gliofilamenti sono una classe di filamenti intermedi, con diametro di 7-8 nm, costituiti di subunitàglobulari piùpiccole di quelle dei neurofilamenti, e a differenza di questi ultimi mancano di braccia laterali. Gli astrociti protoplasmatici predominano nella sostanza grigia del nevrasse; sono meno ricchi di gliofilamenti, hanno un corpo cellulare piùgrande e citoplasma granuloso relativamente abbondante. La loro caratteristica piùsaliente è il pleomorfismo dei suoi numerosi e tenui processi citoplasmatici, che si insinuano tra i costituenti cellulari del neuropilo (il groviglio dei prolungamenti neuronici) sottoforma di esili lamine. Come le cellule della microglia, anche gli astrociti protoplasmatici sono capaci di fagocitosi. Gli astrociti radiali costituiscono il substrato morfologico su cui si orientano le cellule nervose per migrare dal luogo di origine, lo strato ventricolare, fino alla loro specifica sede definitiva. Al termine di tale processo gli astrociti radiali vanno incontro a moltiplicazione e si differenziano in astrociti ordinari. Una delle principali funzioni degli astrociti consiste nella costituzione della barriera ematoencefalica mediante l’avvolgimento con i loro processi dei capillari cerebrali. Essi contribuiscono all’integritàstrutturale della barriera e partecipano agli scambi tra circolo sanguigno e parenchima cerebrale (Figura 3).
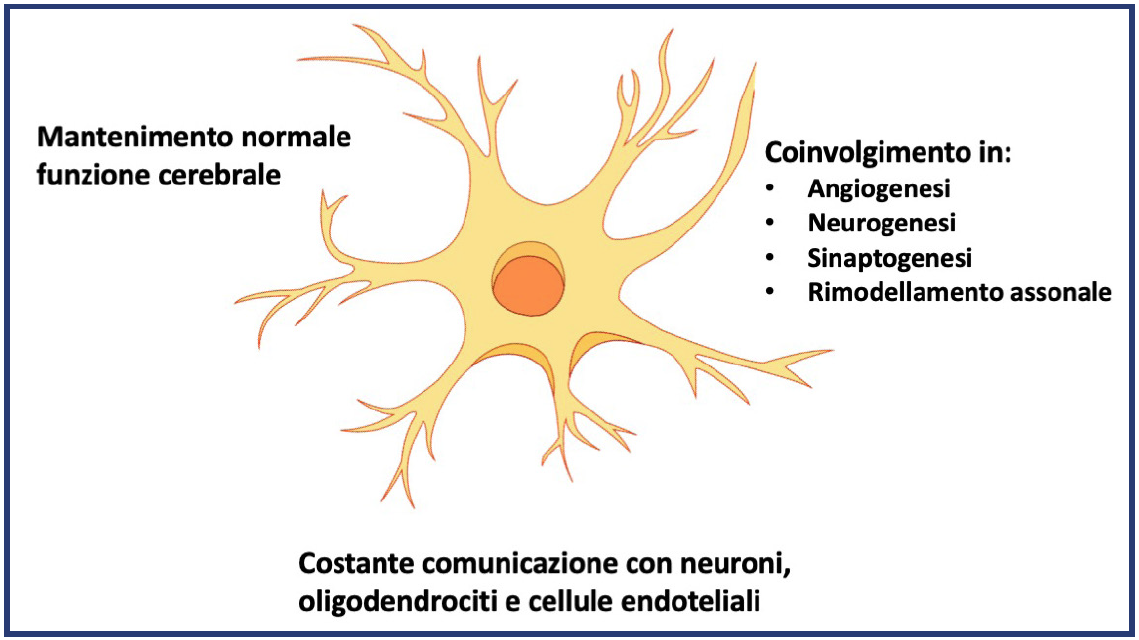 Figura 3. Principali funzioni degli astrociti in condizioni fisiologiche
Figura 3. Principali funzioni degli astrociti in condizioni fisiologiche
Inoltre, gli astrociti rilevano la caduta della pressione di perfusione cerebrale e attivano i circuiti di controllo simpatico autonomo del SNC per aumentare la pressione arteriosa sistemica e la frequenza cardiaca allo scopo di mantenere il flusso sanguigno cerebrale e il rilascio di ossigeno. Studi condotti su animali sperimentali (ratti di laboratorio) mostrano che gli astrociti rispondono a diminuzioni acute della perfusione cerebrale. Il blocco dei meccanismi di segnalazione dipendenti da Ca2 + nelle popolazioni di astrociti che si trovano in prossimitàdei circuiti di controllo simpatico del sistema nervoso centrale previene aumenti compensatori dell’attivitàdel nervo simpatico, della frequenza cardiaca e della pressione arteriosa, indotti da riduzioni della perfusione cerebrale. Queste osservazioni inducono a ritenere che gli astrociti funzionano come barorecettori intracranici e svolgono un ruolo importante nel controllo omeostatico della pressione arteriosa e del flusso sanguigno cerebrale.
Gli astrociti sono, inoltre, importanti per le interazioni con i neuroni adiacenti, essi, infatti, rivestono le terminazioni sinaptiche, assicurando una normale eccitabilitàneuronale grazie al mantenimento dell’omeostasi ionica extracellulare. Anche gli astrociti hanno la capacitàdi rispondere alle condizioni patologiche. Gli astrociti sono attivati dalle citochine prodotte dalla microglia e sono in grado, a loro volta, di produrre molecole pro-infiammatorie. In seguito dell’attivazione, gli astrociti cessano di esercitare le loro funzioni fisiologiche.
Meccanismi molecolari della neuroinfiammazione
Come detto, uno degli eventi precoci della neuroinfiammazione è l’attivazione della microglia nel fenotipo pro-infiammatorio M1, responsabile dell’amplificazione e del mantenimento dello stato neuroinfiammatorio mediante il rilascio di citochine, chemochine, fattori di crescita e radicali liberi dell’azoto e dell’ossigeno (RNS/ROS). Sebbene numerose evidenze della letteratura dimostrino che un’eccesiva ed incontrollata produzione di tali molecole contribuisca all’attivazione di molte vie di segnale nella microglia attivata (Figura 4), i meccanismi molecolari delle neuroinfiammazione restano tuttora da chiarire.
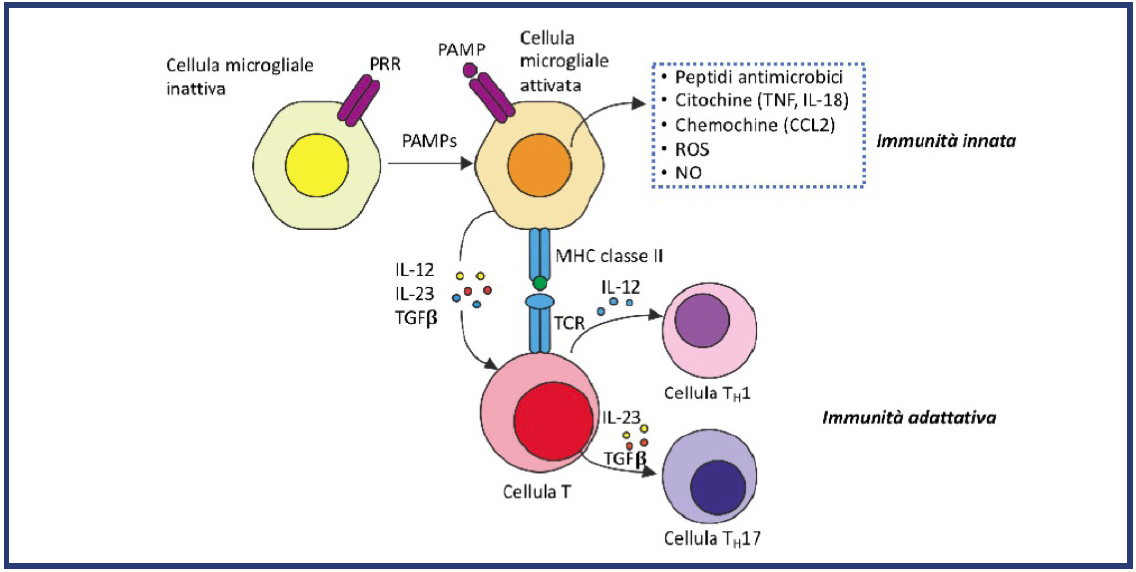 Figura 4: La neuroinfiammazione ècaratterizzata dall’attivazione della microglia e degli astrociti, da infiltrazione di cellule immuni nel SNP e nel SNC (per es., nel midollo spinale), e dalla produzione di mediatori gliali ed infiammatori come le citochine e le chemochine proinfiammatorie, radicali liberi dell’ossigeno (ROS), fattori di crescita e glio-trasmettitori (glutammato ed ATP). Questi mediatori gliali possono modulare potentemente la trasmissione sinaptica eccitatoria ed inibitoria, determinando una sensibilizzazione centrale e stati aumentati di dolore cronico. I mediatori gliali possono ulteriormente agire sulla glia e sulle cellule immuni per facilitare la neuroinfiammazione attraverso vie autocrine e paracrine (da F Salaffi, S. Farah. Fibromialgia: epidemiologia, inquadramento clinico e criteri classificativi. www.rheumalab.it)
Figura 4: La neuroinfiammazione ècaratterizzata dall’attivazione della microglia e degli astrociti, da infiltrazione di cellule immuni nel SNP e nel SNC (per es., nel midollo spinale), e dalla produzione di mediatori gliali ed infiammatori come le citochine e le chemochine proinfiammatorie, radicali liberi dell’ossigeno (ROS), fattori di crescita e glio-trasmettitori (glutammato ed ATP). Questi mediatori gliali possono modulare potentemente la trasmissione sinaptica eccitatoria ed inibitoria, determinando una sensibilizzazione centrale e stati aumentati di dolore cronico. I mediatori gliali possono ulteriormente agire sulla glia e sulle cellule immuni per facilitare la neuroinfiammazione attraverso vie autocrine e paracrine (da F Salaffi, S. Farah. Fibromialgia: epidemiologia, inquadramento clinico e criteri classificativi. www.rheumalab.it)
Le citochine sono una classe di molecole a basso PM (8-80 kDa) che agiscono in modo integrato nella comunicazione cellulare. Oltre al ruolo principale di stimolare il fenomeno infiammatorio, hanno un ruolo nella promozione della crescita, sopravvivenza e differenziazione cellulare. La loro azione però non sempre è positiva, ed il loro ruolo è ancora oggetto di approfondimento. Le IL-1 (interleuchine-1) sono tra le principali molecole effettrici dell’infiammazione; esse rispondono a diversi stimoli infiammatori e sono presenti anche nelle patologie a carattere autoinfiammatorio. La famiglia delle IL-1 conta ben 11 ligandi attivi su diversi recettori specifici. Tra le diverse IL-1 ve ne sono alcune, come IL-1 beta, che agiscono su recettori trans membrana e altre, come IL-33, che mediano risposte a livello nucleare, agendo direttamente da fattori di trascrizione. Le interleuchine capostipiti di questa sottofamiglia sono IL1-α e IL1-β. Esse sono sintetizzate da diversi tipi cellulari, tra cui monociti, neutrofili, epatociti, macrofagi tissutali e la microglia. IL1-α è sintetizzata nel citoplasma a partire da un precursore attivo, e una volta matura resta per la maggior parte legata alla membrana plasmatica. Una frazione è presente a livello nucleare dove agisce in modo autocrino. IL1-β, la piùstudiata che questa famiglia, si distingue dal tipo α perché è sintetizzato come pro-peptide inattivo ed immagazzinato in vescicole. Gli stimoli infiammatori, come il lipopolisaccaride (LPS) e l’adenosina trifosfato (o ATP), determinano la maturazione del pro-peptide ad opera dell’enzima ICE (interleukin converting enzime, chiamato anche Caspasi-1) e la secrezione di IL-1β riveste quindi un ruolo cruciale nella risposta rapida. IL-1β nel cervello è coinvolta nel meccanismo di induzione della febbre, insieme alla IL-6, e nell’attivazione di cellule T, macrofagi e astrociti. Nel SNC IL-1β può mediare gli effetti neurotossici dovuti all’induzione di i-NOS e quindi di NO e di specie radicaliche dell’ossigeno. Nei pazienti fibromialgici è stata anche documentata un’elevata concentrazione cerebrospinale e serica di IL-8, in assenza di un consensuale incremento della IL- 1β. Questo profilo (aumentata IL-8, ma non IL-1β) è in conformitàcon i sintomi della fibromialgia che vengono mediati dall’attivitàsimpatica indotta dallo stress piuttosto che da meccanismi associati alle prostaglandine e avvalorano l’ipotesi dell’attivazione gliale in risposta ai meccanismi del dolore. Questo spiega, inoltre, la mancata risposta ai farmaci antiinfiammatori non steroidei (FANS). La terza principale citochina di questa famiglia è IL-1Ra; essa lega i recettori per IL-1β (IL-1R tipo I e II), ma non è in grado di attivarli, quindi agisce come inibitore specifico. Il TNF-α è considerato una citochina fondamentale nel processo infiammatorio; viene prodotto dai monociti-macrofagi, dalle cellule dendritiche e dai linfociti; nel cervello è prodotto da microglia e astrociti ed esercita un ruolo fondamentale nel dirigere la risposta immune. Esiste sia in forma transmembranaria che solubile. Il bilancio tra la forma di membrana e quella solubile dipende dallo stato di attivazione della cellula ed è cruciale per la sua attività. TNF-α solubile agisce su recettori trans-membrana (TNFR1 e TNFR2) che attivano diverse vie del segnale, tra cui la principale effettrice è quella che coinvolge il fattore di trascrizione NF-kB (nuclear factor kappa-light-chain-enhancer of activated B cells) è un complesso proteico funzionante come fattore di trascrizione, il quale regola positivamente la trascrizione di numerosi geni pro-infiammatori. Nel sistema nervoso TNF-α media importanti funzioni tra cui l’attivazione della microglia e degli astrociti, la regolazione della permeabilitàdella barriera ematoencefalica, l’induzione dello stato febbrile, la trasmissione glutammatergica e la plasticitàsinaptica. IL-6 è anch’essa una citochina pro-infiammatoria prodotta da macrofagi, microglia, astrociti, linfociti T, fibroblasti, cellule endoteliali e cheratinociti. Tra le sue principali funzioni vi sono l’induzione dello stato febbrile, la generazione e la coordinazione della risposta immunitaria. Inoltre, IL-6 è in grado di attivare i linfociti B e indurli a sintetizzare anticorpi. A differenza della IL-1, IL-6 possiede anche delle funzioni antiinfiammatorie, in particolare, inibisce la sintesi di TNF-α e induce la sintesi dei recettori solubili per IL-1 e TNF-α, i quali diminuiscono la quota di citochine disponibili. IL-10 è una potente citochina anti-infiammatoria, prodotta prevalentemente da monociti-macrofagi, microglia e, anche se in minore quantità, dai linfociti. E’ in grado di inibire l’espressione di citochine pro-infiammatorie, come TNF-α, INF-γ, IL-2 e IL-3. Nel cervello svolge un ruolo importante nel controllo dello stato neuroinfiammatorio. Un’importante classe di mediatori della risposta infiammatoria è costituita dai prostanoidi (prostaglandine, prostaciclina e tromboassano), molecole che derivano dall’acido arachidonico. La loro sintesi avviene ad opera della cicloossigenasi (COX) o della prostaglandina-endoperossido sintasi (o PGH-sintasi). Esistono due isoforme di questo enzima: COX-1 e COX-2; esse mediano la stessa funzione catalitica, ma hanno ruoli fisiologici diversi. Infatti, l’enzima COX-1 è espresso costitutivamente in molte cellule dell’organismo, tra cui neuroni, microglia e linfociti e svolge funzioni di mantenimento dell’omeostasi. COX-2 è invece espresso in modo inducibile in seguito ad uno stimolo pro-infiammatorio. Questi enzimi sono il principale target dei farmaci antiinfiammatori non steroidei (FANS). L’espressione di COX- 2 è indotta nell’ambito di molte patologie a carattere neuroinfiammatorio. L’attivitàdelle COX porta alla produzione di specie reattive dell’ossigeno, anch’esse accusate di peggiorare il danno, anche se recenti evidenze hanno mostrato che il ruolo negativo delle COX sia da imputare principalmente alle prostaglandine.
Generalmente, si ritiene che la neuroinfiammazione moduli il dolore cronico promuovendo le interazioni di segnale tra neuroni e cellule gliali. In particolare, le chemochine sono ben posizionate per mediare queste interazioni, in quanto le chemochine ed i loro recettori sono espressi differenzialmente nei neuroni e nelle cellule gliali. Il ruolo delle chemochine nella regolazione della migrazione e dell’attivazione dei leucociti periferici, dell’adesione cellulare e dell’attivazione delle cellule T, così come nell’induzione della sensibilizzazione periferica è ben noto. Le chemochine (chemotactic citokines) sono parte di una superfamiglia di proteine a basso PM (6-14 kDa), attive nel richiamo di varie popolazioni cellulari che partecipano alla risposta immune, come granulociti neutrofili ed eosinofili, monociti e linfociti, oltre che nei processi di migrazione cellulari che hanno luogo durante l’embriogenesi. Le famiglie principali di chemochine sono rappresentate dalle: α-chemochine (o CXC chemochine), che hanno i due residui cisteinici NH2-terminali tra loro separati da un aminoacido non conservato (X); β-chemochine (o CC chemochine), che presentano due residui cisteinici giustapposti; e δ-chemochine (CX3C chemochine), che mostrano i due residui cisteinici separati da tre residui aminoacidici. Le chemochine sono prodotte da una ampia varietàdi tipi cellulari, generalmente coinvolti nelle risposte flogistiche. Esse agiscono su piùtipi cellulari, svolgendo numerose azioni descritte in vitro quali la chemiotassi, il rilascio di enzimi su depositi cellulari, la formazione di radicali dell’ossigeno, la formazione di mediatori lipidici e l’induzione dell’adesione all’endotelio o alla matrice extracellulare. Una delle chemochine piùstudiate appartiene alla famiglia delle CC chemochine ed è la Monocyte Chemoattractant Protein-1 MCP-1/CCL2. CCL2 ha un ruolo fondamentale nell’attrazione dei monociti, delle cellule T e delle cellule NK (Natural Killer); inoltre, è implicata nelle malattie caratterizzate da infiltrazione monocitica. La sua espressione è stata documentata in molte malattie, come l’aterosclerosi, la sclerosi multipla, l’artrite reumatoide e la nefrite. MCP-1 risulta avere anche effetti rilevanti nell’infarto, sull’attivazione e sul reclutamento dei macrofagi, sulla sintesi di citochine e sull’accumulo dei miofibroblasti. La sintesi di MCP-1 da parte degli astrociti e della microglia nel SNC regola l’aumento dell’influsso dei leucociti, che si verifica in seguito a danno assonale oppure in associazione a malattie neuroinfiammatorie, come l’encefalopatia autoimmune, un modello di sclerosi multipla indotta nel ratto. La famiglia delle CXC chemochine svolge invece un ruolo fondamentale nella regolazione della chemiotassi e nell’attivazione dei neutrofili nei tessuti ischemici; ma sono comunque importanti nell’infiammazione indotta da infiltrazione di cellule Th1. Inoltre, le CXC presentano effetti angiostatici ed effetti inibitori sulla migrazione dei fibroblasti. RANTES (Regulated upon Activation, Normal T-cell Expressed) fa parte della famiglia delle CC-chemochine, viene prodotto da linfociti T circolanti CD8+, cellule endoteliali, fibroblasti, piastrine e nel cervello da microglia e astrociti. La sua funzione principale è il reclutamento dei leucociti nei siti infiammatori; attiva anche il rilascio, da parte degli eosinofili, delle proteine cationiche eosinofiliche. RANTES aumenta, inoltre, l’aderenza dei monociti alle cellule endoteliali e supporta selettivamente la migrazione dei monociti e dei linfociti T che esprimono sulla superficie i marcatori CD4. Infine, attiva i basofili e causa il rilascio di istamina. L’aumento di espressione di RANTES è associato a numerose patologie infiammatorie, e sembra esercitare un ruolo importante nella risposta antivirale. Il Platelet Derived Growth Factor (PDGF) è una chemochina isolata dalle piastrine e sintetizzata dai megacariociti come un fattore di crescita per il tessuto connettivo e le cellule gliali; la proteina biologicamente attiva è un dimero composto da due polipeptidi collegati denominati PDGF-A (platelet derived growth factor subunit A) e PDGF-B (platelet derived growth factor subunit B). Gli eterodimeri di PDGF sono espressi da una varietàdi tipi cellulari, come macrofagi, cellule endoteliali, fibroblasti e cellule muscolari lisce. Il PDGF stimola la proliferazione degli astrociti ed inibisce la prematura differenziazione delle cellule progenitrici; è inoltre coinvolto nello sviluppo del sistema nervoso centrale in quanto i recettori dell’isoforma PDGF-b sono espressi in molte aree del cervello. Il PDGF-B e il suo recettore PDGFR-β sono espressi anche a livello neuronale, e un aumento di espressione di queste proteine è stato rilevato in cervelli post-mortem di pazienti con ischemia. Il PDGF ha un ruolo nell’indirizzare e regolare il differenziamento di diverse cellule staminali, tra cui le cellule staminali neuronali presenti nella zona subventricolare e subgranulare. Interferon Inducible Protein (IP-10 o CXCL10) è un membro della famiglia delle chemochine CXC. L’IFN-γ induce l’espressione di IP-10 in diversi tipi cellulari, come monociti, cellule endoteliali, cheratinociti, fibroblasti e microglia. L’IP-10 ha attivitàchemoattrattrice per i monociti e le cellule T nell’uomo e promuove l’adesione delle cellule T alle cellule endoteliali; inoltre, in vivo è in grado di inibire l’angiogenesi e dimostra attivitàantitumorale. Nel cervello viene prodotto soprattutto dalla microglia e concorre ad esacerbare lo stato infiammatorio e la sua neutralizzazione o deplezione risulta essere neuroprotettiva. La Neural Regeneration Protein (NRP) è una chemochina espressa nelle cellule staminali e nelle cellule gliali. Può indurre migrazione e proliferazione cellulare, promuovere la sopravvivenza neuronale e aumentare lo sviluppo dei neuriti; induce inoltre la differenziazione delle cellule staminali neuronali in neuroni. NRP esercita i suoi effetti sulla sopravvivenza neuronale attraverso la fosforilazione di ERK-1 e ERK-2, due chinasi citosoliche.
L’impronta cerebrale del dolore cronico: il ruolo del neuroimaging
La diagnosi e la gestione delle sindromi da dolore cronico rimane un importante sfida clinica, ed un eventuale fallimento è in parte attribuito alla nostra incapacitàdi identificare le alterazioni del sistema nervoso che si pensa contribuiscano a queste sindromi. Trovare cambiamenti neurochimici oggettivi nel cervello dovrebbe aiutare a ridurre il persistente stigma che molti pazienti affrontano, considerando che i loro sintomi vengono definiti immaginari. La mancanza di una diagnosi specifica e oggettiva per le sindromi da dolore cronico algodisfunzionale come la fibromialgia può comportare un ritardo della diagnosi e decisioni di gestione subottimali. Inoltre, identificare la corretta fonte di dolore è di importanza fondamentale poiché il decorso clinico e gli interventi terapeutici sono diversi a seconda del meccanismo fisiopatologico. Negli ultimi 30 anni si è cercato un biomarcatore clinico, laboratoristico o di neuroimaging che rendesse la diagnosi di fibromialgia sensibile e specifica. Una varietàdi studi scientifici ha fornito evidenze consistenti sulla presenza di alterazioni della struttura morfologica del sistema nervoso centrale, dell’attivitàmetabolica e dello stato di connettivitàtra le varie aree cerebrali che inducono a ritenere che il dolore, nei pazienti fibromialgici, possa essere associato ai seguenti meccanismi: ipereccitabilitàdel sistema nocicettivo, trasmissione degli impulsi aumentata (facilitazione), amplificazione centrale ed a ridotti meccanismi di controllo inibitorio.
Le tecniche di neuroimaging funzionale hanno permesso di definire le aree del cervello attivate dagli input nocicettivi, permettendo di “visualizzare il dolore” o comunque di rilevare quelle aree del cervello che costituiscono la cosiddetta “pain matrix” (Figura 5).
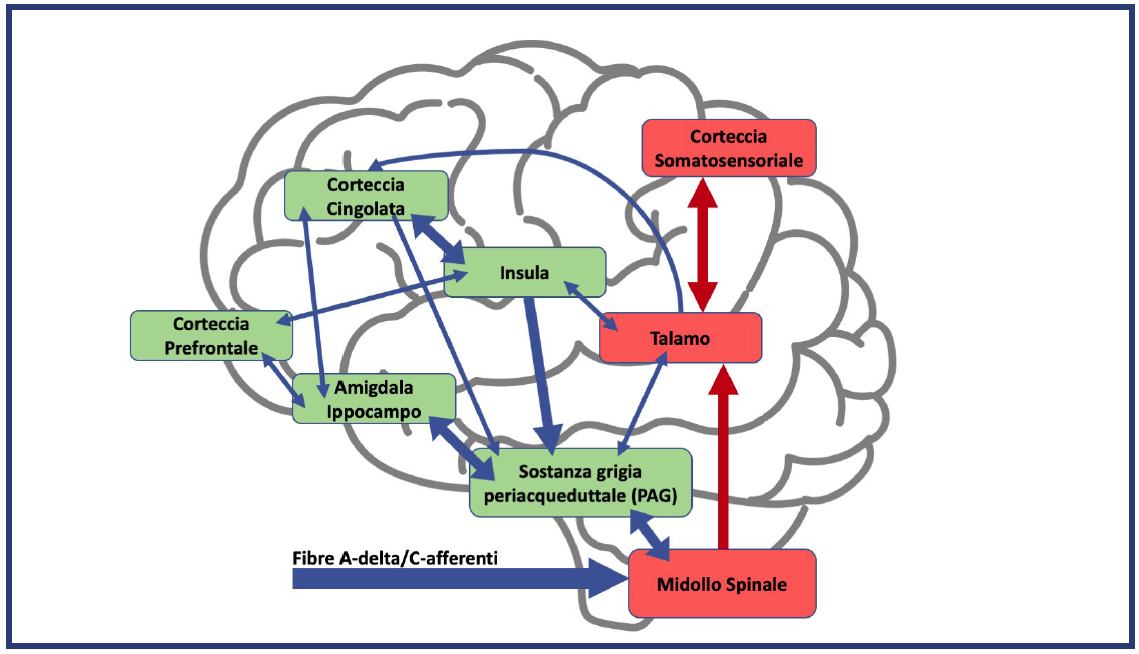 Figura 5. Vasta rete neurale encefalica, denominata “pain matrix”. La neuromatrice è costituita da una componente somato-sensoriale, limbica e talamo corticale che costituiscono la parte sensoriale, discriminativa, affettiva-emozionale e valutativo-cognitiva dell’esperienza dolorosa.
Figura 5. Vasta rete neurale encefalica, denominata “pain matrix”. La neuromatrice è costituita da una componente somato-sensoriale, limbica e talamo corticale che costituiscono la parte sensoriale, discriminativa, affettiva-emozionale e valutativo-cognitiva dell’esperienza dolorosa.
Queste aree sono attivate durante la codifica della localizzazione del dolore nocicettivo, della sua intensità, durata, qualitàe delle relazioni emozionali e mostra come il dolore possa essere influenzato da attenzione, distrazione e manipolazione dell’umore. Perciò, grazie a queste ricerche l’attenzione si è oggi focalizzata sulle importanti componenti non sensoriali del dolore e si è arrivati alla conclusione che il dolore cronico è associato ad apparenti variazioni del cervello, rafforzando la visione dello stesso come una malattia del SNC. La identificazione di tali mappe ha scatenato un dibattito serrato in ambito scientifico e pertanto deve essere interpretata con cautela, considerate le numerose limitazioni metodologiche e la sua semplicistica definizione di mappa del dolore.
Le tecniche di neuroimaging sono tecniche di neurovisualizzazione che permettono di esplorare “dall’esterno” le strutture corporee attraverso la costruzione di immagini che possono fornire informazioni utili per la diagnosi della malattia. Recentemente studi di neuroimaging hanno documentato alterazioni consistenti e ricorrenti nell’ambito del SNC in pazienti affetti da FM. In generale, è stata riscontrata una significativa riduzione della densitàneuronale ovvero una diminuzione della sostanza grigia cerebrale in numerose aree cerebrali deputate all’elaborazione dell’input nocicettivo (e.g., talamo, corteccia somatosensoriale primaria, corteccia prefrontale, corteccia cingolata anteriore), espressione verosimile di un invecchiamento precoce cerebrale, non Alzheimer o etàanagrafica – correlato. Anche aree coinvolte nei processi mnestici (come le aree paraippocampali) sono spesso interessate.
Con le moderne apparecchiature di risonanza magnetica (RM) ad alto campo sono possibili studi sofisticati in vivo della struttura anatomica e funzionale del cervello umano. E’, infatti, verosimile ottenere informazioni sia “strutturali”, cioè sulle caratteristiche anatomiche del cervello, sia “funzionali”, ossia dipendenti dal funzionamento delle diverse aree cerebrali. Le tecniche avanzate di RM permettono di visualizzare con elevata precisione e dettaglio anatomico eventuali anomalie della materia cerebrale, non solo dovute alla presenza di danni strutturali (lesioni o displasie corticali), ma anche legate ai meccanismi di interazione biochimica e biofisica delle cellule nervose. Oltre all’esame RM tradizionale, dove vengono prodotte una serie di immagini ad alta risoluzione per lo studio anatomico, le nuove tecniche di neuroimaging consentono di misurare la concentrazione e la distribuzione spaziale dei complessi processi metabolici cerebrali, di ottenere misure non invasive di perfusione tissutale (PWI) con lo studio del flusso ematico cerebrale con tecnica di Arterial Spin Labelling, di avere una rappresentazione tridimensionale dei tratti di fibre della sostanza bianca encefalica attraverso lo studio del movimento delle molecole di acqua nei tessuti (DTI), e di identificare aree di attivazione corticale con tecniche di risonanza magnetica funzionale. Gli elevati livelli di risoluzione sia spaziale che temporale ottenibili e l’assenza di radiazioni ionizzanti e di agenti contrastografici costituiscono ulteriori punti di forza delle metodiche funzionali in RM.
Risonanza Magnetica funzionale (fMRI)
Si basa sulla registrazione delle variazioni dei livelli del flusso ematico e dell’ossigenazione cerebrale, attualmente una delle tecniche piùindicate per studiare l’attivitàcerebrale nell’uomo. Questa tecnica è in grado di visualizzare la risposta emodinamica, ossia i cambiamenti nel contenuto di ossigeno del parenchima e dei capillari, correlata all’attivitàneurale del cervello. Permette di rilevare i collegamenti tra l’attivazione del cervello e i compiti motori o cognitivi che il soggetto esegue durante la scansione. Grazie alle sue caratteristiche di non invasività, la fMRI si presenta come un formidabile strumento di ricerca per la comprensione delle relazioni esistenti tra struttura cerebrale, funzionalitàcerebrale ed eventuali patologie. La fMRI è in grado di identificare mappe delle regioni attivate nel cervello dopo l’esecuzione di compiti da parte del soggetto, registrando le variazioni dell’attivitàneuronale legate al flusso sanguigno cerebrale regionale (rCBF) ed alla variazione del consumo di ossigeno (CMRO2). Recentemente, la fMRI ha permesso di documentare alterazioni consistenti e ricorrenti nell’ambito del SNC in pazienti affetti da fibromialgia. In particolare, sono state documentate alterazioni morfologiche cerebrali di tipo atrofico in alcune specifiche aree deputate alla percezione, all’elaborazione e alla modulazione del dolore. Queste alterazioni, attribuibili a fenomeni di neuroplasticità, sono state riscontrate nel giro cingolato, nella corteccia orbito-frontale, nell’insula e nella regione dorsale del ponte. Poiché sembra che i pazienti affetti da dolore cronico abbiano questa comune “impronta cerebrale” in aree coinvolte nella regolazione del dolore, ci si chiede se questi cambiamenti siano la causa o la conseguenza del dolore cronico. Nell’analisi morfologica dei pazienti fibromialgici sono state osservate alcune regioni che mostrano uno spessore corticale (Cortical Thickness, CT), significativamente maggiore: a sinistra l’insula posteriore e il giro frontale inferiore – parte orbitale, a destra il giro frontale inferiore – parte opercolare. Inoltre, la connettivitàdella sostanza grigia periacqueduttale (PAG) è risultata maggiore nelle pazienti rispetto ai controlli. In particolare, l’analisi della connettivitàdell’insula posteriore ha evidenziato un focus significativamente piùcorrelato nelle pazienti rispetto ai controlli nel cingolo posteriore; inoltre la connettivitàdell’insula correlava: (1) con la durata del dolore in cingolo anteriore e medio, corteccia opercolare e precuneo; (2) con l’estensione del dolore in corteccia precentrale e premotoria e cingolo posteriore; infine, (3) con l’aspetto affettivo del dolore in un complesso di vari cluster, fra cui cingolo posteriore e precuneo, cingolo subgenuale, giro postcentrale e mesencefalo. Tali evidenze rappresentano un contributo allo studio dei meccanismi neurofisiologici della fibromialgia, e quindi potenzialmente alla definizione di criteri diagnostici piùsoddisfacenti ed alla identificazione di nuovi target terapeutici per questa sindrome. Un certo numero di studi di imaging cerebrale ha, inoltre, riportato un’aumentata attivazione del sistema di processazione del dolore nei pazienti fibromialgici (se confrontati con controlli sani) in risposta a stimoli dolorosi, confermando la presenza di un sistema iperattivato di percezione e processazione del dolore. Piùdi recente, la fMRI è stata studiata in pazienti a riposo, ossia non sottoposti a stimoli dolorosi, con l’intenzione di identificare, eventualmente, marcatori di dolore spontaneo clinicamente rilevante. Una connettivitàfunzionale alterata in condizione di riposo è stata identificata tra la rete neurale distribuita in diverse regioni corticali e sottocorticali, che viene attivata durante le ore di riposo e di attività“passive” (connettivitàfunzionale intrinseca), e la corteccia insulare. In relazione alla percezione del dolore, la corteccia insulare nel suo ruolo di centralino all’interno del sistema di percezione del dolore, è interessata sia nel codificare l’intensitàdel dolore (corteccia insulare posteriore), ma anche nei meccanismi di processazione e di apprendimento del dolore stesso (corteccia insulare anteriore). In altre parole, nella fibromialgia la documentata presenza di iperconnettivitàdella corteccia insulare ad altre componenti del sistema di processazione del dolore e altri sistemi convolti (rete neuronale intrinseca) renderebbe il cervello vulnerabile all’aumentata percezione del dolore e allo sviluppo di uno stato doloroso cronico. Parallelamente, studi neuropsicologici hanno rilevato la presenza di deficit cognitivi, prevalentemente a carico delle funzioni mnestiche (e.g., working memory o “memoria di lavoro”) ed attentive. Tali deficit di performance sono risultati congrui con le alterazioni cerebrali rilevate negli studi di neuroimaging.
Spettroscopia protonica con Risonanza Magnetica (H-MRS)
Un’altra tecnica di neuroimaging è la spettroscopia protonica con risonanza magnetica (H-MRS); si tratta di un esame diagnostico non invasivo, che identifica i livelli di alcuni metaboliti in specifiche strutture anatomiche, in base al loro spettro di risposta caratteristico alle sequenze di impulsi di risonanza magnetica (Figura 6).
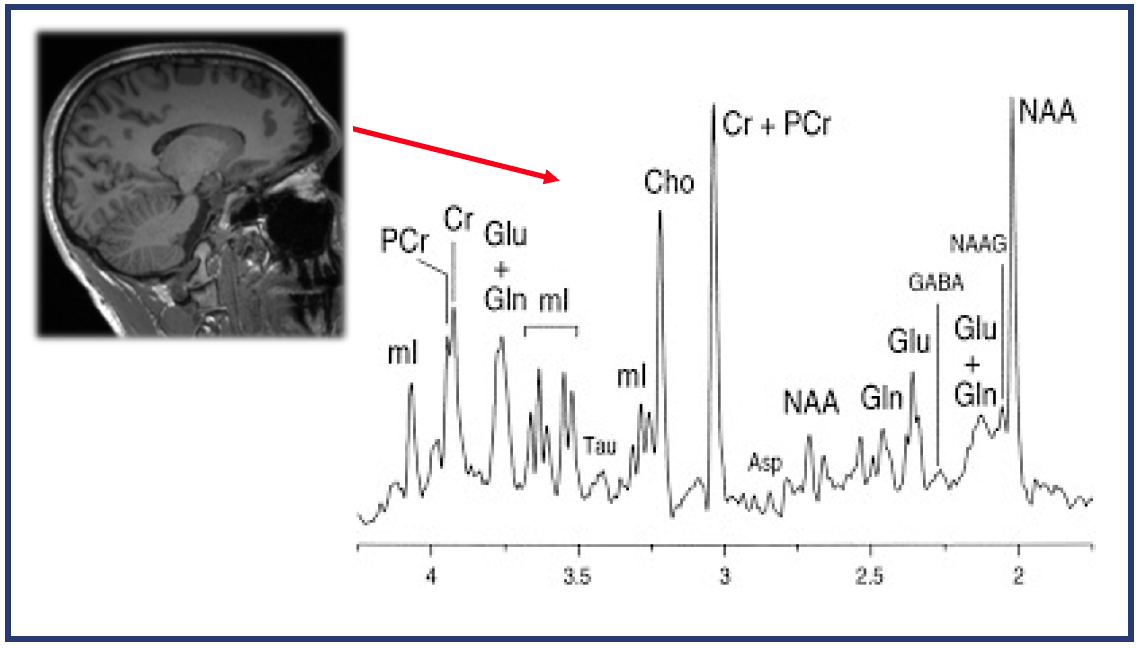 Figura 6. La risonanza magnetica spettroscopica protonica permette di ottenere dei grafici, chiamati spettri, che rappresentano la presenza e la quantità dei diversi metaboliti (i diversi picchi) in una certa zona del cervello campionata, mediante applicazione di particolari sequenze che vengono successivamente analizzate mediante software dedicati.
Figura 6. La risonanza magnetica spettroscopica protonica permette di ottenere dei grafici, chiamati spettri, che rappresentano la presenza e la quantità dei diversi metaboliti (i diversi picchi) in una certa zona del cervello campionata, mediante applicazione di particolari sequenze che vengono successivamente analizzate mediante software dedicati.
In particolare, in base alla frequenza di risonanza, il software di elaborazione è in grado di identificare la concentrazione dei principali metaboliti nell’area di esame. I cambiamenti nella concentrazione di un dato metabolita possono, infatti, riflettere alterazioni metaboliche in una data popolazione di cellule cerebrali. Pertanto, attraverso la combinazione dei singoli picchi, è possibile valutare il metabolismo dell’area in esame e le caratteristiche della lesione. La H-MRS si basa sulle proprietàchimico-fisiche degli ioni idrogeno legati non all’acqua, come avviene per le immagini di risonanza magnetica, ma a molecole differenti ed altrettanto importanti dal punto di vista metabolico. In base alla loro concentrazione in un campione di tessuto (voxel), sono in grado di fornire, con sequenze opportune, uno spettro, ovvero un grafico, cui i picchi ne indicano la presenza e l’altezza dei picchi ne indica la concentrazione (Figura 6). Si tratta quindi di una tecnica che si aggiunge all’imaging convenzionale e che può rivelarsi molto utile, soprattutto nei problemi di diagnosi differenziale o nella valutazione della risposta terapeutica delle lesioni tumorali. Nell’ultima decade questa tecnica è stata anche utilizzata per l’investigazione in vivo della patofisiologia dei disturbi psichiatrici. Nel tessuto cerebrale i metaboliti di maggiore rilevanza sono:
- N-Acetyl-Aspartato contenuto nei neuroni sani: una riduzione indica un processo patologico che distrugge i neuroni (tumori, accidenti vascolari) o ne determina un depauperamento funzionale (malattie metaboliche o infiammatorie)
- Colina contenuta nelle membrane cellulari: un aumento indica una mitosi molto accelerata, come avviene nei tumori
- Creatina, marker di un normale metabolismo energetico: essendo sempre presente viene presa come picco di riferimento per gli altri metaboliti
- Myo-Inositolo, indice astrocitario: aumenta in ogni processo che determini una intensa reazione astrocitaria, come ad esempio nei focolai infiammatori.
Nei pazienti affetti da dolore cronico si è riscontrato che i livelli dei metaboliti neuroinfiammatori, in particolare il myo-inositolo e la colina, sono elevati. E’ stato, inoltre, evidenziato come i livelli di glutammato risultino aumentati nel liquido cerebrospinale alla H-MRS cerebrale dei pazienti con fibromialgia, mentre i livelli di acido gamma aminobutirrico (GABA) siano diminuiti. L’azione della corteccia anteriore del cingolo sulla modulazione del dolore non èancora del tutto chiarita, ma si suppone che il rilascio di neuro-trasmettitori inibitori come GABA e gli oppioidi, riduca l’eccitabilità dei neuroni di questa regione, i quali sono responsabili della modulazione discendente del dolore, agendo sui neuroni del midollo rostrale ventro-mediale. E’ anche coinvolto il meccanismo della sommazione temporale del dolore (o “windup”), sostenuto dalla ripetitiva stimolazione delle fibre nocicettive.
Lo Studio della perfusione con Risonanza Magnetica (Perfusion weighted o PWI)
È una tecnica di imaging biomedico che utilizza particolari sequenze di risonanza magnetica al fine di studiare la perfusione dell’encefalo. I dati acquisiti tramite imaging a risonanza magnetica vengono post elaborati per ottenere mappe di perfusione con parametri diversi, come il volume ematico cerebrale, il flusso ematico cerebrale, il tempo di transito medio e il tempo al picco. Esistono tre tipi di sequenze per ottenere immagini pesate in perfusione:
- Dynamic susceptibility contrast, (DSC). Viene iniettato gadolinio come mezzo di contrasto e vengono acquisite immagini in rapida ripetizione (generalmente gradient-echo pesate in T2) per quantificare la perdita di segnale indotta dalla suscettibilità.
- Dynamic contrast enhanced, (DCE). Misurazione dell’accorciamento del rilassamento T1 indotto da un bolo di mezzo di contrasto di gadolinio.
- Arterial spin labelling, (ASL). Marcatura magnetica del sangue arterioso prima che entri nella regione di interesse dell’imaging. Non è necessario infondere gadolinio come mezzo di contrasto.
Sono state evidenziate nella fibromialgia anormalità perfusionali rispetto ai controlli, con un’attività elevata nella corteccia somato-sensoriale e ridotta nella corteccia frontale, nel cingolo, nella corteccia temporale e cerebellare.
Tomografia ad emissione di positroni (PET)
La tomografia ad emissione di positroni (PET), è una delle principali tecniche di imaging nel campo della radiologia e della medicina nucleare. Questa tecnica fornisce informazioni solo di tipo fisiologico e si basa sull’emissione di radiazioni gamma dal corpo del paziente a seguito dell’iniezione di opportuni radioligandi. La diagnostica PET è costituita da una matrice circolare di rivelatori sintonizzati per rilevare fotoni a livello di energia specifica creata dalla annichilazione positrone/elettrone. Software topografici assemblano questi segnali in immagini che mostrano la localizzazione e la concentrazione dei radiofarmaci iniettati nel paziente. La brevità della vita media di questi isotopi garantisce un basso livello di dose rilasciata al paziente, ma causa la necessità di un ciclotrone in-loco, o comunque non lontano, per la loro utilizzazione. Per studi che necessitano di diversi giorni di osservazione, si usa l’isotopo 124I (T1 /2 = 4,1 gg). Questi radioligandi sono incorporati in composti normalmente usati dall’organismo come il glucosio (o analoghi del glucosio), acqua o ammoniaca o in molecole che si legano ai recettori o in altri siti di azione dei farmaci. Una delle caratteristiche che rende cosìimportante la PET per gli studi fisiologici, èla sua capacità di individuare variazioni metaboliche nanomolari, tipiche degli organismi e delle funzionalità cellulari. Le maggiori applicazioni dell’imaging PET sono la detezione dei tumori al cervello, seno, cuore e polmoni. In neurologia, la PET è particolarmente indicata per la sua capacità di mostrare l’attività dei neurorecettori, i quali hanno una concentrazione troppo bassa (μmol, o inferiore) per essere investigata con altre tecniche diagnostiche. La PET presenta peròanche alcuni limiti. Il range medio percorso dai positroni prima di annichilire è, in acqua (che è il maggior componente dei tessuti biologici), di circa 1-2 mm, e varia a seconda del particolare radionuclide usato. Ciòcomporta una degradazione nella risoluzione spaziale dell’immagine, poichèla rivelazione dei fotoni in coincidenza elettronica porta alla determinazione del punto di annichilazione della coppia, e non del punto in cui il positrone viene emesso. Questo èil cosiddetto “effetto range”. Inoltre, l’emissione dei fotoni di annichilazione non avviene esattamente back-to-back, ma si ha una piccola deviazione angolare. Tenendo conto del solo moto termico delle particelle si dovrebbe avere emissione dei fotoni a 180°± 0.25° ma ciò non concorda con i risultati sperimentali. In effetti, la deviazione angolare èmaggiore ed èdovuta all’instaurarsi di uno stato legato elettrone-positrone, chiamato positronio. Tale stato legato puòinteragire con elettroni esterni, annichilando con essi (pick-off) e provocando l’aumento della dispersione angolare dei fotoni. Le distorsioni dell’immagine dovute all’effetto range e alla deviazione angolare non sono matematicamente rimovibili, e costituiscono una limitazione fondamentale della PET. Tuttavia, la loro entità è tale da essere trascurata se non si usano tomografi con elevata risoluzione spaziale, o distanze elevate tra rivelatori e paziente.
Imaging integrato: dalla TC-PET alla PET-RM
L’attuale frontiera nell’utilizzo delle radiazioni (ionizzanti e non) in ambito clinico èquello di utilizzare tecniche combinate, in particolare modo accoppiando fra loro due apparecchiature di diagnostica per immagini, o anche una apparecchiatura di diagnostica per immagini e una di terapia radiante. Le tecniche combinate offrono, nel primo caso il vantaggio di ottenere non solo dettagli anatomici, ma anche informazioni funzionali, nonchésullo stato biochimico di un particolare distretto corporeo, nel secondo caso la possibilità di individuare e definire con maggiore capacità di dettaglio l’organo bersaglio sul quale operare con la metodica radioterapica.
Accoppiare un approccio anatomico ed un approccio funzionale èalla base dell’imaging ibrido, proprio perchéil medesimo rappresenta una metodica basata sull’integrazione di imaging morfologico, basato sull’interazione dei raggi X con il tessuto o organo, che consente di ottenere informazioni di tipo anatomico ed imaging funzionale che, grazie all’utilizzo e somministrazione di traccianti radioattivi, consente di studiare diverse funzioni biologiche e processi metabolici cellulari. In tal senso, tra i possibili accoppiamenti di metodiche diverse, quello che oggi mostra margini più promettenti riguarda l’utilizzo combinato della tomografia ad emissione di positroni (PET) con la tomografia a risonanza magnetica (RM). Grazie all’avanzamento tecnologico delle moderne apparecchiature, attualmente i sistemi integrati sono di fatto massimamente integrati, ovvero inseriti in un unico sistema, contrariamente a quanto succedeva anni fa, allorquando il lettino porta paziente ruotava fra i due tomografi separati, posti affacciati l’uno all’altro. In tal modo le immagini PET e le immagini RM vengono acquisite simultaneamente con un unico sistema integrato, mantenendo il paziente nella stessa posizione, e consentendo un ottimale allineamento delle due acquisizioni. Le immagini cosìottenute sono ricostruite in modo da fornire sia immagini separate, e sia immagini di fusione delle due metodiche in cui èpossibile visualizzare esattamente il sito anatomico in cui si èandato a concentrare il radiofarmaco. Tutto ciòèrealizzato grazie all’utilizzo di una sola zona comandi di acquisizione e di una di ricostruzione e visualizzazione delle immagini di fusione. Questa combinazione ha dimostrato di essere assai promettente in oncologia ma comporta una dose di esposizione particolarmente significativa, elemento fortemente condizionante per esempio in pediatria, o comunque nel trattamento delle patologie non oncologiche o di quelle che, pur essendo oncologiche, sono ancora in uno stato primordiale. Sulla scorta di questa esperienza, si ècercato di sviluppare ulteriori possibilità di accoppiamento fra tecnologie di diagnostica, ed in tal senso èapparsa quasi naturale, per i motivi che si evidenzieranno in seguito, la combinazione della PET con la risonanza magnetica, poichéentrambe presentano vantaggi e svantaggi che in qualche modo possono renderle felicemente complementari all’interno di un unico sistema. La PET, infatti, ècaratterizzata da una forte sensibilità rispetto ad un’ampia gamma di processi biologici, ma anche da una bassa risoluzione spaziale che ne limita la capacità informativa rispetto ad una specifica informazione anatomica. La RM consente lo studio della morfologia e la caratterizzazione tissutale, con miglior contrasto evidentemente riservato alle parti molli, ed èconnotata da un’alta risoluzione spaziale, ma presenta una bassa sensibilità per i processi biologici patologici, proprio in virtù della natura stessa di questo genere di diagnostica clinica. Per quanto sopra, il vantaggio di fondere le due metodiche èconseguentemente quello di eliminare i rispettivi limiti ed ottenere accurate immagini di tipo morfologico e di caratterizzazione tissutale grazie all’utilizzo della RM, con possibilità di utilizzare anche specifiche sequenze di acquisizione e mezzo di contrasto se necessario, e le informazioni di funzionalità e vitalità cellulare fornite dalla PET, aspetto chiave per la diagnosi precoce di alterazioni funzionali che precedono sempre temporalmente l’insorgenza di alterazioni strutturali. La diagnostica per immagini PET/ RM (tomografia a emissione di positroni/risonanza magnetica) con radioligandi della proteina traslocatrice (Translocator Protein, TSPO), presente su tutte le cellule cerebrali, è in grado di rilevare le patologie mitocondriali del cervello e, piùspecificamente, è stata riscontrata una correlazione positiva tra il potenziale di legame anomalo del radioligando e la gravitàclinica. In particolare, uno studio del 2015 del team di Loggia et al. ha utilizzato la scansione MR/PET combinata per documentare la neuroinfiammazione, in particolare l’attivazione delle cellule gliali, nel cervello di pazienti con lombalgia cronica. Ipotizzando che un’analoga attivazione gliale possa essere riscontrata anche nei pazienti con fibromialgia, il suo team ha impiegato lo stesso radiofarmaco PET, che si lega alla proteina transmembrana TSPO sovraespressa da cellule gliali attivate. La TSPO è localizzata a livello della membrana mitocondriale esterna di molti tipi di cellule. Risulta ampiamente espressa nelle cellule gliali e in molti tessuti periferici e la sua espressione basale sembra venir alterata in concomitanza di un certo numero di patologie, come il cancro, disturbi neurodegenerativi, disturbi cerebrali, infiammazione e ansia, rivestendo, quindi, un ruolo importante sia nella regolazione della proliferazione cellulare e dell’apoptosi, che nella biosintesi degli steroidi. La proteina traslocatrice ha assunto un rilevante interesse come possibile target terapeutico e diagnostico. Nel SNC il TSPO èespressa prevalentemente nelle cellule microgliali. L’attivazione della microglia dà inizio ad una risposta infiammatoria che puòesacerbare la perdita neuronale in varie malattie infiammatorie neurodegenerative, come ad esempio l’Alzheimer. Poichési èosservata una sovraespressione di TSPO nella microglia attivata, si èpensato che l’infiammazione presente a livello cerebrale nelle patologie neurodegenerative coinvolga tale recettore. Si presenta cosìla possibilità di utilizzare degli specifici ligandi per il TSPO per prevenire o controllare la neuroinfiammazione. E’ plausibile, pertanto, ipotizzare che, attraverso l’utilizzo del TSPO come marker di tali cellule, sia possibile determinare con esattezza quale ruolo la neuroinfiammazione gioca in specifiche condizioni patologiche che coinvolgono il SNC, aprendo cosìle porte al trattamento farmacologico e all’inibizione della progressione della malattia. MR / PET miscela i dettagli strutturali e funzionali dei tessuti che una risonanza magnetica fornisce con la sensibilitàe la funzione metabolica fornite dalle scansioni PET. Nello specifico, la scansione PET rileva la radiazione emessa da una sostanza iniettata in una persona, chiamata radiotracciante, che segue la sua distribuzione in tutto il corpo. Il team di Loggia ha ipotizzato che i pazienti con fibromialgia possano anche aver attivato cellule gliali, provando a dimostrare di utilizzare la loro strategia PET per visualizzare 20 pazienti con fibromialgia e 16 volontari sani. Il radiotracciante che hanno usato si lega alla TSPO, una proteina i cui livelli sono aumentati nella microglia attivata e negli astrociti.
Per coincidenza, un approccio simile è stato progettato dal laboratorio di Kosek et al. presso il Karolinska Institute, dove sono stati arruolati 11 pazienti con fibromialgia, sei dei quali hanno ricevuto il tracciante PET TSPO-binding. Inoltre, sono stati reclutati 11 individui sani come controllo che hanno ricevuto un tracciante PET che si lega preferenzialmente agli astrociti e non alla microglia. I ricercatori di entrambi gli istituti hanno deciso di combinare i loro set di dati – in totale, hanno analizzato 31 pazienti con fibromialgia e 27 controlli sani. Le analisi hanno rivelato che il cervello dei pazienti con fibromialgia mostra un’attivazione gliale significativamente maggiore rispetto ai controlli sani. Rispetto al cervello dei pazienti con dolore cronico, l’aumento di TSPO era piùdiffuso nei pazienti con fibromialgia. E’ plausibile, quindi, ipotizzare che attraverso l’utilizzo del TSPO come marker di tali cellule sia possibile determinare con esattezza quale ruolo la neuroinfiammazione gioca in specifiche condizioni dolorose croniche che coinvolgono il SNC. Studi futuri dovrebbero esaminare se gli stessi schemi di attivazione gliale sono visibili nei pazienti con altre forme di dolore cronico o se particolari “firme gliali” possono differenziare sindromi specifiche o differenti pattern di alterazione neurofisiologica.
Conclusioni
Riusciremo nel tempo a definire uno stretto rapporto tra alterazioni neurofisiologiche e sintomi della fibromialgia? E’ possibile, anche se la fibromialgia rimane la conclusione clinica di innumerevoli percorsi dei pazienti, in cui la vulnerabilitàgenetica, gli eventi stressanti, il profilo di personalitàgiocano un ruolo che con fatica può essere spiegato con l’impiego di metodiche di neuroimaging. In ogni caso la ricerca deve proseguire e l’osservazione di aree cerebrali iper o ipofunzionanti nei pazienti affetti da fibromialgia potrebbe essere utile per definirne la tipologia, ma anche per un approccio terapeutico meno empirico e piùbasato su criteri scientifici e riproducibili.
Diagnosticare la fibromialgia su misurazioni cerebrali oggettive potrebbe essere importante per varie ragioni. Lo status di fibromialgia come sindrome basata su oggettive disfunzioni fisiologiche è stato contestato, in parte perchè non è chiaro se cambiamenti centrali e periferici siano sufficienti per porre diagnosi di fibromialgia e spiegarne i sintomi. Una caratterizzazione oggettiva basata su reperti cerebrali può rivelare pattern di alterazioni neurofisiologiche caratteristiche della popolazione fibromialgica (vs controlli sani), potendo potenzialmente attribuire una specifica componente neuronale a questa sindrome. Ovviamente quale sia il primum movens di una sindrome così polimorfa è difficile da stabilire; gli aspetti genetici, la forma fisica, i traumi e gli stressors di qualunque tipo possono contribuire a un alterato setting neurofisiologico e pertanto alla lettura di un quadro alterato in termini di risonanza magnetica funzionale o di PET/RM. Il neuroimaging cerebrale può fornire, comunque, preziose informazioni sul meccanismo d’azione delle terapie utilizzate per il trattamento del dolore cronico e contribuire a rafforzare l’uso di approcci integrati incentrati sul paziente per la gestione di questa condizione. L’utilizzo di radioligandi specifici per il TSPO e delle tecniche di imaging ibride potrebbero consentire la visualizzazione di una eventuale perdita neuronale e della gravità della neuroinfiammazione e ciòpuòessere un valido strumento per determinare un differente trattamento per uno specifico paziente. Inoltre, grazie alla localizzazione della microglia attivata èpossibile anche determinare lo stadio della malattia e la risposta al trattamento farmacologico (duloxetina, pregabalin, naltrexone low dose, palmitoiletanolamide, L-acetil-carnitina, ecc). I dati attualmente disponibili possono essere un passo importante verso lo sviluppo di biomarcatori per condizioni di dolore cronico associato alla fibromialgia.
Punti chiave
- L’attivazione delle cellule gliali e’ stata invocata come fattore causale nello sviluppo e nel mantenimento del dolore cronico. Tale meccanismo può spiegare sindromi da sensibilizzazione centrale con amplificazione del dolore e presenza di una generalizzata allodinia ed iperalgesia, come la fibromialgia.
- Recentemente studi di neuroimaging, quali la risonanza magnetica funzionale, la risonanza magnetica di perfusione, la spettroscopia protonica con risonanza magnetica, la tomografia ad emissione di positroni e le piùrecenti tecniche di imaging integrato quali la PET/RM (tomografia a emissione di positroni/risonanza magnetica) hanno consentito di documentare alterazioni della struttura morfologica, dell’attivitàmetabolica e dello stato di connettivitàtra le varie aree cerebrali nella fibromialgia.
- Gli studi di neuroimaging suggeriscono che il dolore fibromialgico può essere associato a: (1) ipereccitabilitàdel sistema nocicettivo; (2) trasmissione degli impulsi aumentata (facilitazione); (3) amplificazione centrale; (4) ridotti meccanismi di controllo inibitorio.
- E’ plausibile ipotizzare che attraverso l’utilizzo del neuroimaging sia possibile determinare quale ruolo la neuroinfiammazione gioca in specifiche condizioni dolorose croniche che coinvolgono il SNC. Studi futuri dovrebbero esaminare se gli stessi schemi di attivazione gliale sono visibili nei pazienti con altre forme di dolore cronico o se particolari “firme gliali” possono differenziare sindromi specifiche o meccanismi patologici.
- Le macchine ibride risultano sempre piùdiffuse e le acquisizioni delle immagini ibride comportano differenze in termini funzionali e morfologici rispetto alle macchine tradizionali, migliorando le prestazioni sia a livello qualitativo che quantitativo. L’uso combinato di radiofarmaci e mezzi di contrasto utilizzati in radiologia comporta modalitàspecifiche di acquisizione, ricostruzione delle immagini e correzione dei movimenti che richiedono una formazione specifica, sia a livello teorico che pratico.
Bibliografia
- Vergne-Salle P, Bertin P. Chronic pain and neuroinflammation. Joint Bone Spine. 2021;88(6):105222
- Ji RR, Nackley A, Huh Y, Terrando N, Maixner W. Neuroinflammation and Central Sensitization in Chronic and Widespread Pain. Anesthesiology. 2018 Aug;129(2):343-366
- Matsuda M, Huh Y, Ji RR. Roles of inflammation, neurogenic inflammation, and neuroinflammation in pain. J Anesth. 2019;33(1):131-139.
- Loggia ML, Chonde DB, Akeju O, Arabasz G, Catana C, Edwards RR, Hill E, Hsu S, Izquierdo-Garcia D, Ji RR, Riley M, Wasan AD, Zürcher NR, Albrecht DS, Vangel MG, Rosen BR, Napadow V, Hooker JM. Evidence for brain glial activation in chronic pain patients. Brain. 2015;138(Pt 3):604-15.
- Albrecht DS, Forsberg A, Sandström A, Bergan C, Kadetoff D, Protsenko E, Lampa J, Lee YC, Höglund CO, Catana C, Cervenka S, Akeju O, Lekander M, Cohen G, Halldin C, Taylor N, Kim M, Hooker JM, Edwards RR, Napadow V, Kosek E, Loggia ML. Brain glial activation in fibromyalgia – A multi-site positron emission tomography investigation. Brain Behav Immun. 2019 Jan;75:72-83.
- Lo YC, Li TJT, Lin TC, Chen YY, Kang JH. Microstructural Evidence of Neuroinflammation for Psychological Symptoms and Pain in Patients With Fibromyalgia. J Rheumatol. 2022 May 2:jrheum.211170. doi: 10.3899/jrheum.211170.
- Best L, Ghadery C, Pavese N, Tai YF, Strafella AP. New and Old TSPO PET Radioligands for Imaging Brain Microglial Activation in Neurodegenerative Disease. Curr Neurol Neurosci Rep. 2019 Apr 2;19(5):24.
- Tronel C, Largeau B, Santiago Ribeiro MJ, Guilloteau D, Dupont AC, Arlicot N. Molecular Targets for PET Imaging of Activated Microglia: The Current Situation and Future Expectations. Int J Mol Sci. 2017 Apr 11;18(4):802.
- Janssen B, Vugts DJ, Windhorst AD, Mach RH. PET Imaging of Microglial Activation-Beyond Targeting TSPO. Molecules. 2018 Mar 8;23(3):607.
- Li T, Zhang S, Ikeda E, Kobinata H. Functional connectivity modulations during offset analgesia in chronic pain patients: an fMRI study. Brain Imaging Behav. 2022 Aug;16(4):1794- 1802.
- Cheng JC, Anzolin A, Berry M, Honari H, Paschali M, Lazaridou A, Lee J, Ellingsen DM, Loggia ML, Grahl A, Lindquist MA, Edwards RR, Napadow V. Dynamic Functional Brain Connectivity Underlying Temporal Summation of Pain in Fibromyalgia. Arthritis Rheumatol. 2022;74(4):700-710
- Cagnie B, Coppieters I, Denecker S, Six J, Danneels L, Meeus M. Central sensitization in fibromyalgia? A systematic review on structural and functional brain MRI. Semin Arthritis Rheum. 2014;44(1):68-75.
- Bettini L, Moore K. Central Sensitization in Functional Chronic Pain Syndromes: Overview and Clinical Application. Pain Manag Nurs. 2016;17(5):333-8.
- Atzeni F, Masala IF, Salaffi F, Di Franco M, Casale R, Sarzi- Puttini P. Pain in systemic inflammatory rheumatic diseases. Best Pract Res Clin Rheumatol. 2015;29(1):42-52.
- Salaffi F, Giacobazzi G, Di Carlo M. Chronic Pain in Inflammatory Arthritis: Mechanisms, Metrology, and Emerging Targets-A Focus on the JAK-STAT Pathway. Pain Res Manag. 2018 Feb 7;2018:8564215.
- Di Carlo M, Cesaroni P, Salaffi F. Neuropathic pain features suggestive of small fibre neuropathy in fibromyalgia syndrome: a clinical and ultrasonographic study on female patients. Clin Exp Rheumatol. 2021 May-Jun;39 Suppl 130(3):102-107.
- Salaffi F, Di Carlo M, Bazzichi L, Atzeni F, Govoni M, Biasi G, et al. Definition of fibromyalgia severity: findings from a cross-sectional survey of 2339 Italian patients. Rheumatology (Oxford). 2021 Feb 1;60(2):728-736.
- Nakagawa Y, Chiba K. Role of microglial m1/m2 polarization in relapse and remission of psychiatric disorders and diseases. Pharmaceuticals (Basel). 2014 Nov 25;7(12):1028-48.
- Sundgren PC, Petrou M, Harris RE, Fan X, Foerster B, Mehrotra N, Sen A, Clauw DJ, Welsh RC. Diffusion-weighted and diffusion tensor imaging in fibromyalgia patients: a prospective study of whole brain diffusivity, apparent diffusion coefficient, and fraction anisotropy in different regions of the brain and correlation with symptom severity. Acad Radiol. 2007;14(7):839-46.
- Ren K, Dubner R. Interactions between the immune and nervous systems in pain. Nat Med 2010;16:1267–76.
- Tsuda M. P2 receptors, microglial cytokines and chemokines, and neuropathic pain. J Neurosci Res 2017;95:1319–29.
- Facci L, Barbierato M, Skaper SD. Astrocyte/microglia cocultures as a model to study neuroinflammation. Methods Mol Biol. 2018; 1727:127–37.
- Ji RR, Xu ZZ, Gao YJ. Emerging targets in neuroinflammation-driven chronic pain. Nat Rev Drug Discov. 2014; 13:533–48.
- Seo S, Jung YH, Lee D, Lee WJ, Jang JH, Lee JY, Choi SH, Moon JY, Lee JS, Cheon GJ, Kang DH. Abnormal neuroinflammation in fibromyalgia and CRPS using [11C]-(R)- PK11195 PET. PLoS One. 2021 Feb 8;16(2):e0246152.
- Arnold LM, Williams DA, Hudson JI, Martin SA, Clauw DJ, Crofford LJ, Wang F, Emir B, Lai C, Zablocki R, et al. Development of responder definitions for fibromyalgia clinical trials. Arthritis Rheum. 2012;64(3):885–94.
- Salaffi F, Di Carlo M, Bazzichi L, Atzeni F, Govoni M, Biasi G, Di Franco M, Mozzani F, Gremese E, Dagna L, Batticciotto A, Fischetti F, Giacomelli R, Guiducci S, Guggino G, Bentivegna M, Gerli R, Salvarani C, Bajocchi G, Ghini M, Iannone F, Giorgi V, Farah S, Cirillo M, Bonazza S, Barbagli S, Gioia C, Santilli D, Capacci A, Cavalli G, Carubbi F, Nacci F, Riccucci I, Sinigaglia L, Masullo M, Polizzi BM, Cutolo M, Sarzi-Puttini P. Definition of fibromyalgia severity: findings from a cross-sectional survey of 2339 Italian patients. Rheumatology (Oxford). 2021;60(2):728-736.
