SPONDILODISCITI INFIAMMATORIE NON INFETTIVE ED INFETTIVE: DIAGNOSTICA DIFFERENZIALE E RUOLO DELLA RISONANZA MAGNETICA
AUTORI:
Fausto Salaffi1, Luca Ceccarelli 2, Marina Carotti 3, Giancarlo Facchini 4, Marco Di Carlo1, Gabriele Polonara3, Rita Golfieri4, Andrea Giovagnoni 3
Introduzione
La spondilodiscite è un’infiammazione localizzata a livello delle vertebre (spondilite) e dei dischi intervertebrali (discite), provocata da malattie infiammatorie o infettive (Tabella 1), la cui diagnosi e gestione resta, tuttora, non semplice (1). Le spondilodisciti rappresentano il 4% circa di tutte le infezioni ossee. Le principali malattie infiammatorie che colpiscono la colonna vertebrale, comprendono le spondiloartriti (SpA), la sinovite-acne- pustulosi-iperostosi-osteite (SAPHO), la discopatia degenerativa “attiva” o MODIC di tipo 1, la discite acuta calcifica da malattia da deposizione di cristalli di idrossiapatite (HADD), la gotta a localizzazione spinale (secondaria a deposizione di cristalli di urato monosodico) e la sindrome spondiloartropatica distruttiva dell’emodializzato cronico. Le spondilodisciti infettive possono essere dovute ad infezioni da piogeni o a condizioni non piogeniche, come le infezioni granulomatose, fungine e parassitarie (Tabella 1). La diagnosi è sospettata in caso di dolori vertebrali a carattere infiammatorio e di una sindrome biologica da flogosi, mentre la febbre è presente solo una volta su due.
Attualmente, la risonanza magnetica (RM) rappresenta la tecnica di prima scelta nella diagnosi delle spondilodisciti, per la sua elevata sensibilità, specificità e accuratezza diagnostica. La RM è più sensibile rispetto alla radiologia convenzionale e alla tomografia computerizzata (TC) nel riconoscimento delle lesioni infiammatorie o un focolaio di osteomielite a livello vertebrale. Il gruppo ASAS/OMERACT ha reso disponibili le definizioni standardizzate per le lesioni spinali rilevate dalla RM per singoli distretti anatomici (2). Vi è generale consenso che la presenza di edema osseo intraspongioso a carico degli spigoli di tre o più corpi vertebrali è altamente suggestiva di axial-SpA, soprattutto nei pazienti più giovani (2,3). Le anomalie associate alla malattia degenerativa “attiva” del disco intervertebrale, chiamata Modic tipo-1, includono alterazioni del disco intervertebrale e dell’osso subcondrale vertebrale adiacente (4). Le alterazioni di segnale sono caratterizzate da una bassa intensità sulle sequenze pesate in T1 e da un segnale iperintenso nelle sequenze pesate in T2, con evidente aumento dell’enhancement contrastocafico, nella sede ove è presente l’edema del midollo osseo. Lesioni infiammatorie che coinvolgono il midollo osseo, le capsule e i legamenti articolari e la sinovite possono coesistere in altre malattie non infettive come la sindrome di SAPHO, la discite acuta calcifica, la gotta spinale e la spondiloartropatia dell’emodializzato cronico (5).
Nelle spondilodisciti infettive, la diffusione dell’agente patogeno alla colonna vertebrale può avvenire per via ematica, per contiguità, come conseguenza di un’infezione postoperatoria e per localizzazione diretta. La localizzazione batterica per via ematogena èla modalità di infezione più frequente, soprattutto nei giovani, e può avvenire per via arteriosa o per via venosa. La diffusione per contiguità èun’evenienza rara nella quale l’infezione delle vertebre e dei dischi vertebrali ècausata dalla propagazione di un processo settico paravertebrale. Si tratta, solitamente, di un’infezione, tubercolare o micotica, localizzata primitivamente alla colonna vertebrale, con successiva diffusione nei tessuti circostanti, che poi penetra in altri corpi vertebrali. L’infezione diretta èla conseguenza di manovre strumentali come la discografia eseguita a scopo diagnostico o eseguita come guida per la terapia di chemionucleolisi; puòanche conseguire a interventi di nucleo-aspirazione o infiltrazione di anti-dolorifici a livello delle radici nervose. In questi casi la sede iniziale del processo infettivo èrappresentata dal disco intervertebrale e la vertebra èinteressata solo successivamente.
Qualsiasi elemento della colonna vertebrale: le vertebre, i dischi, i tessuti molli circostanti e il midollo stesso possono essere coinvolti singolarmente, o più comunemente, in combinazione (6). Lo stafilococco aureo è l’organismo che si trova più frequentemente, insieme ai batteri Gram negativi, spesso come conseguenza di infezioni delle vie urinarie e nei tossicodipendenti per via endovenosa. La tubercolosi spinale è la forma più pericolosa, in quanto può causare la distruzione del corpo vertebrale, deformità spinale e/o paraplegia. La spondilite e la spondilodiscite sono, inoltre, una complicanza frequente e importante dell’infezione brucellare (7).
I fattori di rischio per l’insorgenza di infezioni fungine sono le condizioni immunosoppressive, il diabete mellito, la terapia antibiotica o parenterale ad ampio spettro prolungata e il ricovero in reparti di terapia intensiva. L’interessamento della colonna vertebrale in corso di infezioni parassitarie, come quella da Echinococco, è estremamente raro, anche nelle aree endemiche.
La differenziazione tra spondilodiscite non infettiva e infettiva è una sfida diagnostica. Una diagnosi corretta richiede che siano soddisfatti due criteri principali: la presenza di lesioni caratteristiche a livello della colonna vertebrale e l’isolamento del patogeno dal sangue o dalla sede dove è presente l’infezione. Pertanto, la valutazione radiologica è importante non solo per la diagnosi della spondilodiscite, ma anche per l’ulteriore pianificazione e monitoraggio del trattamento. La RM rappresenta la tecnica di imaging di scelta per l’individuazione e la valutazione della spondilodiscite, con valori di sensibilità, specificità ed accuratezza diagnostica rispettivamente del 96%, 92% e il 94% (8).
In questa rassegna viene fatta una panoramica sulla semeiotica delle lesioni radiologiche evidenziabili radiologicamente a livello della colonna vertebrale nelle spondilodisciti non infettive e infettive, focalizzando l’attenzione sul ruolo della RM e discutendo le caratteristiche cliniche e patologiche rilevanti che aiutano la diagnosi precoce e differenziale.
Malattie infiammatorie non infettive della colonna vertebrale
Diverse malattie infiammatorie non infettive possono coinvolgere la colonna vertebrale. Tra queste, le axial-SpA, la sindrome di SAPHO, le degenerazioni vertebrali secondarie a discopatia attiva (denominata MODIC tipo 1), la discite calcifica acuta o la gotta tofacea sono le cause più comuni di questa categoria di spondilodisciti. Le spondiloartropatie destruenti possono essere riscontrate in pazienti emodializzati a lungo termine per conseguente deposito di amiloide nella colonna vertebrale (Tabella I).
SPONDILOARTRITI
Il termine di spondiloartriti o SpA è stato introdotto per definire un gruppo di malattie reumatiche infiammatorie ad andamento cronico, classificate tra le affezioni su base immunitaria (Immune-Mediated Infiammatory Disease). Attualmente, le SpA vengono suddivise in sette sottotipi principali: la spondilite anchilosante (SA), l’artrite psoriasica (AP), le spondiloartriti reattive, le spondiloartriti enteropatiche (associate a malattie infiammatorie croniche intestinali, quali la colite ulcerosa e la malattia di Crohn), le spondiloartriti indifferenziate, le spondiloartriti dell’infanzia o giovanili e l’uveite anteriore acuta – HLA-B27 positiva (1,3). Le più comuni sono la SA e l’AP. L’avvento delle nuove metodiche di imaging, in particolare della RM e la disponibilità di nuovi e più efficaci trattamenti farmacologici hanno rinnovato l’interesse verso la classificazione delle SPA. Il concetto di “spondiloartrite assiale” comprende i vari stadi della malattia, da quello più precoce, in cui non vi è evidenza di danno radiografico e il coinvolgimento sacro-iliaco può essere evidenziato solo con la RM (stadio “non-radiografico”) a quello più tardivo in cui sono evidenti il danno osseo secondario a sacroileite e l’anchilosi della colonna. La diagnosi di SPA assiale in stadio “non-radiografico” può essere effettuata combinando parametri clinici, di laboratorio e tecniche di imaging, in particolare la RM, che consente di evidenziare la flogosi delle articolazioni sacroiliache all’esordio della malattia. Da parte del gruppo ASAS (Assessment of SpondyloArthritis International Society) (http://asas-group.org/mission-statement.php) (3) è stato introdotto un utile algoritmo diagnostico che prevede il precoce riconoscimento del dolore infiammatorio del rachide e la presenza dei segni clinici peculiari di tale gruppo di affezioni (storia familiare, entesiti, uveite, glutealgia basculante, artrite periferica, dattilite, psoriasi, malattie infiammatorie intestinali, risposta al trattamento con antinfiammatori non-steroidei, incremento degli indici di flogosi) o, in alternativa, la positività dell’antigene HLA-B27 e il riscontro dei tipici reperti di infiammazione attiva a carico delle articolazioni sacroiliache alla RM o di sacroileite alla radiologia convenzionale (Figura 1).

Figura 1. Criteri ASAS per la classificazione delle spondiloartriti assiali
La RM consente la visualizzazione dell’edema osseo intraspongioso, del versamento articolare, dell’entesite, della capsulite e della sinovite. Con l’utilizzo di sequenze appropriate, tale tecnica di imaging permette anche l’evidenziazione delle lesioni tipiche della fase radiologica e tardiva, quali le erosioni, la sclerosi subcondrale, la neoproduzione ossea, fino all’anchilosi, e gioca, pertanto, un ruolo fondamentale anche nella identificazione e quantificazione del danno strutturale e nella valutazione della sua progressione nel tempo. In corso di SpA, come per le articolazioni sacroiliache, anche per la valutazione dell’impegno del rachide, la RM gioca un ruolo fondamentale nella fase non-radiologica. Essa rappresenta, infatti, l’unica tecnica di imaging in grado di visualizzare l’edema osseo intraspongioso/osteite, la flogosi nella sede di inserzione dei tendini, dei legamenti, delle strutture capsulo-legamentose e del disco intervertebrale (9,10). Analogamente alle articolazioni sacro-iliache, anche nel rachide, il processo infiammatorio acuto si manifesta come aree di iperintensità di segnale nelle sequenze T2 pesate, meglio evidenziata nelle sequenze con soppressione del grasso e in quelle T1 pesate con soppressione del grasso e mezzo di contrasto paramagnetico, in relazione ad “enhancement” contrastografico da ipervascolarizzazione. L’utilizzo del mezzo di contrasto paramagnetico appare particolarmente indicato nello studio delle fasi più precoci della malattia, sia per la valutazione del rachide che delle articolazioni sacro-iliache. Gli svantaggi sono legati alla maggiore invasività, ai costi, al maggiore tempo necessario per condurre l’esame e alla sua controindicazione in pazienti con insufficienza renale severa (2,9,10). Nella Tabella II sono riassunte le principali definizioni delle lesioni infiammatorie acute del rachide in corso di axial-SpA in RM.

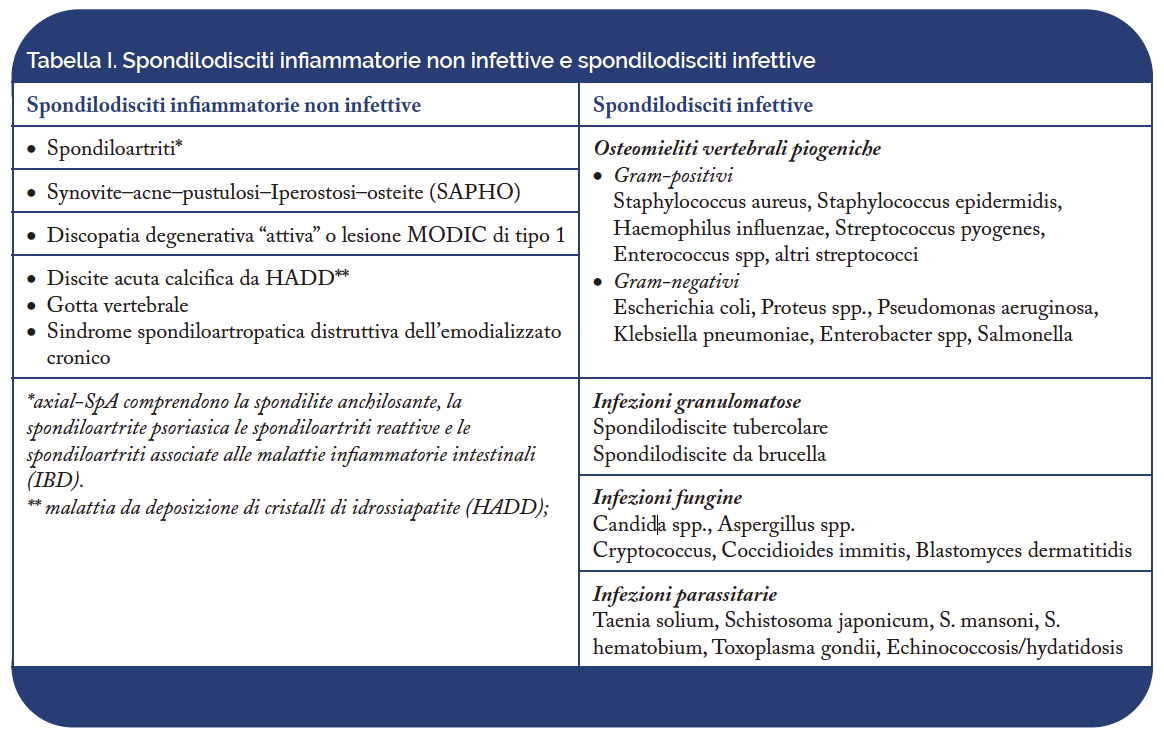
Nelle axial-SpA, tipicamente, sono coinvolti i corpi vertebrali, in corrispondenza degli spigoli somatici anteriori (lesione di Romanus) e posteriori (spondilite posteriore), nella sede di inserzione dell’anulus fibroso, a livello della spongiosa adiacente ai dischi intervertebrali alterati, in relazione a spondilodiscite e delle articolazioni zigoapofisarie (Figura 2), costovertebrali, sternocostali e manubriosternali. Con il termine di spondilodiscite si intende un’alterazione “erosiva” della giunzione disco vertebrale che è un’unità composta dal disco intervertebrale e da metà del corpo vertebrale sovra e sottostante.
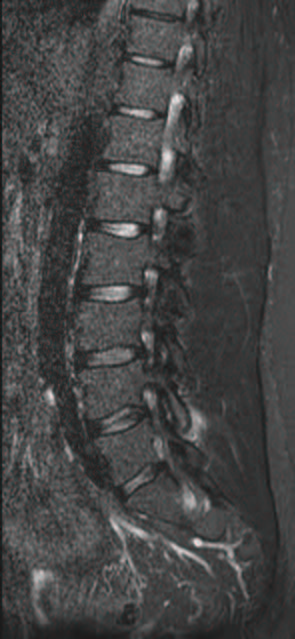
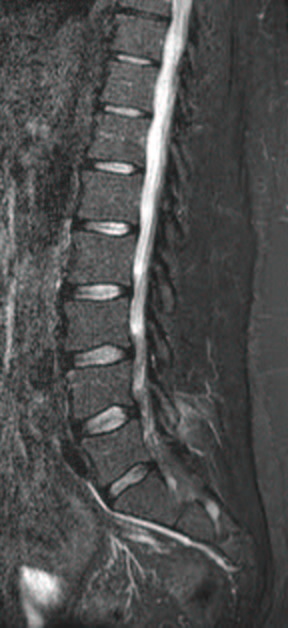
Figura 2. Sequenze STIR T2 sagittali del rachide lombare a-b): edema e distensione dell’articolazione interapofisaria laterale sinistra L4-L5 con estensione dell’infiammazione alle parti molli circostanti.
La spondilodiscite spesso è asintomatica e pertanto la sua frequenza può essere sottostimata; si riscontra con maggior frequenza nei soggetti con malattia di lunga durata ed interessa prevalentemente il tratto lombare o quello toracico inferiore. L’edema osseo intraspongioso (BME) in corso di axial-SpA ha, spesso, una distribuzione a livello degli spigoli somatici, coinvolgendo più livelli, non necessariamente contrapposti, in assenza di patologia degenerativa discale (11). I foci erosivi a carico della giunzione disco-vertebrale possono essere localizzati anteriormente agli spigoli vertebrali (spondilite anteriore di Romanus), oppure coinvolgere l’intera articolazione (lesione di Andersson) (12) rendendo complessa, specialmente nella fase iniziale della axial-SpA, la diagnosi differenziale con le spondilodisciti infettive. La lesione di Andersson viene riconosciuta nel 8% – 16% dei casi di axial-SpA (13- 14). L’esame radiologico convenzionale mostra, negli stadi avanzati della malattia, irregolarità delle limitanti somatiche dei corpi vertebrali adiacenti al disco intervertebrale coinvolto, con aspetti erosivi, circondati da sclerosi. La RM consente di evidenziare tale lesione, già nelle fasi precoci della malattia e tipicamente si manifesta come aree di iperintensità di segnale a livello del disco intervertebrale e dell’osso spongioso dei corpi vertebrali adiacenti nelle sequenze T2 pesate o T1 pesate, con somministrazione di mezzo di contrasto. Solitamente, presenta una bassa intensità di segnale nelle sequenze T1 pesate ed una alta intensità di segnale alla sequenza short tau inversion recovery (STIR). E’, inoltre, frequente l’interessamento flogistico delle entesi dei legamenti sovraspinosi, interspinosi e dei legamenti gialli (9). Fra le lesioni strutturali croniche, il gruppo ASAS/OMERACT, ha identificato nell’infiltrazione di tessuto adiposo intra-spongioso a livello degli angoli vertebrali, la lesione elementare più specifica e rappresentativa (alto rapporto di verosimiglianza o likelihood ratio) del coinvolgimento assiale in corso di axial-SpA, specialmente se presente a più livelli, in particolare nei pazienti più giovani. L’infiltrazione di tessuto adiposo intraspongioso rappresenta la conseguenza del processo infiammatorio acuto, ha una distribuzione simile all’edema osseo (spigoli somatici) e va ricercata nelle sequenze T1 pesate (2,3,9).
SINOVITE, ACNE, PUSTOLOSI, IPEROSTOSI E OSTEITE: SINDROME SAPHO
La sindrome SAPHO è una rara malattia infiammatoria, potenzialmente invalidante, che si contraddistingue per l’associazione, anche non simultanea, di manifestazioni cutanee e disturbi muscoloscheletrici cronici, recidivanti e infiammatori con manifestazioni extra-assiali, in particolare sinovite, iperostosi e osteite. Le manifestazioni cutanee della SAPHO sono rappresentate dalla pustolosi palmo-plantare, dall’acne severa con tutte le sue varianti, ma anche dal Pyoderma gangrenosum e da alcune dermatiti neutrofile, quali la sindrome di Sneddon-Wilkinson e la sindrome di Sweet. L’inquadramento nosografico della SAPHO è ancora oggetto di dibattito, in quanto alcuni la considerano una variante dell’artropatia psoriasica, mentre altri la considerano una malattia autoinfiammatoria (15). L’esordio della malattia varia dall’infanzia all’età adulta, con un’età media tra 30 e 40 anni. L’esordio del dolore osseo e articolare, con rigidità e gonfiore, è spesso insidioso. La febbre può essere presente. Negli adulti, l’infiammazione si manifesta soprattutto nella parte superiore del torace, ma anche nella colonna vertebrale, e meno spesso nella mandibola e nelle ossa iliache; nei bambini, l’infiammazione ha una distribuzione simile a quella dell’osteomielite non batterica. Quando presente, la sinovite si manifesta per lo più a livello delle articolazioni sacroiliache, delle anche, delle ginocchia e delle articolazioni sterno-clavicolari. I pazienti presentano per lo più disturbi muscoloscheletrici come dolore, tumefazione o limitazione del movimento. La colonna vertebrale rappresenta la seconda sede più comune di coinvolgimento scheletrico in tutte le età, dove si riscontrano anomalie nel 32-52% dei pazienti adulti (16). Potenzialmente, tutte le vertebre possono essere interessate, dal tratto cervicale medio all’osso sacro; tuttavia, la colonna toraco-lombare è il sito di coinvolgimento più frequente. Le manifestazioni scheletriche assiali in corso di SAPHO possono assumere diverse espressioni e possono verificarsi in varie combinazioni (17) (Figura 3).
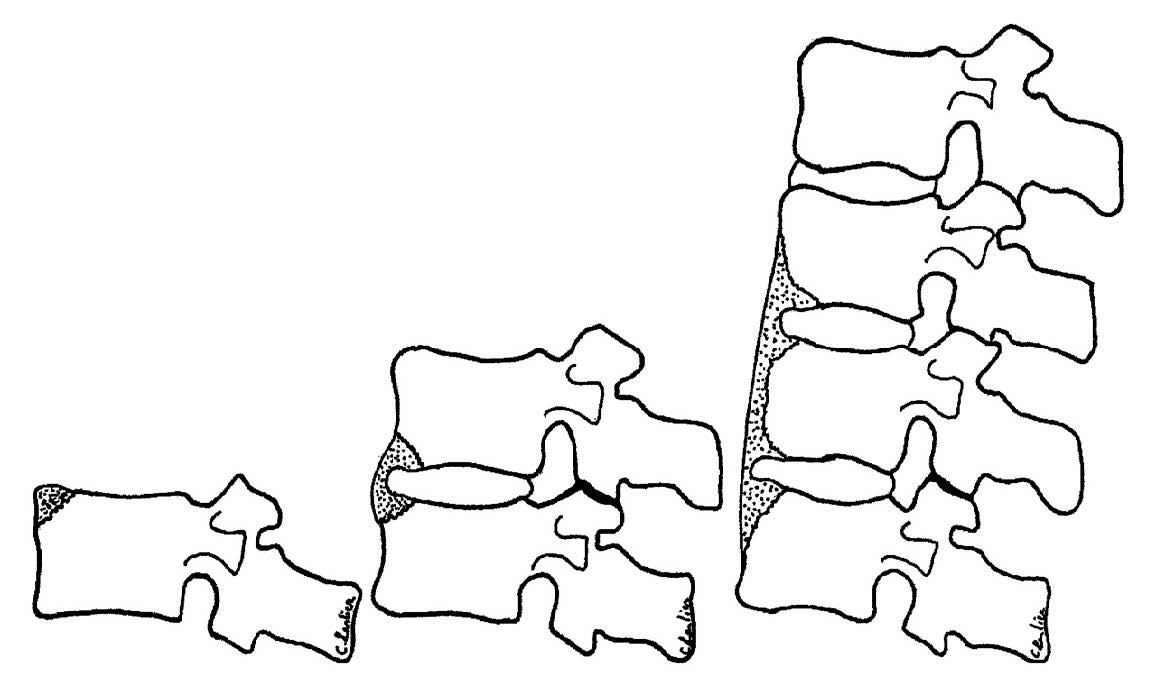
Figura 3. Schema illustrativo di differenti tipologie di coinvolgimento vertebrale in corso di SAPHO.
Queste includono l’interessamento di più spigoli vertebrali, la spondilodiscite che assomiglia a quella infettiva, lesioni osteolitiche con gradi variabili di collasso del corpo vertebrale, sia in adulti che nei bambini, così come l’osteosclerosi di uno o più corpi vertebrali, con lo sviluppo di iperostosi, ossificazione paravertebrale, e sacroileite, di solito negli adulti (16-18). L’erosione a livello dello spigolo del corpo vertebrale alla RM può indicare un’entesite equivalente alla lesione radiografica di Romanus evidenziata nelle axSpA. In presenza di lesioni attive, la RM, nelle sequenze fluido-sensibili, in particolare la STIR, possono evidenziare edema del midollo osseo e dei tessuti molli, una caratteristica che consente di distinguere le lesioni attive da quelle croniche (19). Le lesioni attive mostrano una diminuzione dell’intensità del segnale sia focale che diffusa nelle immagini pesate in T1, e un’alta intensità del segnale nelle immagini pesate in T2 ed in particolare nella STIR. Quando la flogosi si riduce a livello “dell’angolo luminoso” o della lesione di Romanus, il segnale da ipointenso diventa iperintenso nelle sequenze T1 pesate a causa della degenerazione grassa post-infiammatoria del midollo osseo (20). Gli aspetti della spondilodiscite a livello di due o più vertebre contigue, con erosioni corticali e sclerosi subcondrale, in corrispondenza delle limitante somatiche contrapposte, può essere presente nei pazienti con SAPHO e può assomigliare ad una spondilodiscite infettiva. Queste lesioni sono di solito localizzate nella parte centrale o anteriore della giunzione discovertebrale fino al 29-32% dei casi e possono essere la manifestazione iniziale della SAPHO (21). Lo spazio intervertebrale è di solito ben mantenuto, ma può essere ridotto. La RM evidenzia la presenza e l’estensione dell’edema intraspongioso a livello dei corpi vertebrali, che può essere localizzato a livello delle erosioni in corrispondenza delle limitanti somatiche oppure diffuso ed apparire iperintenso nelle sequenze fluido sensibili. Nella maggior parte di queste lesioni, la bassa intensità del segnale del disco nelle immagini fluido-sensibili e l’assenza dell’enhancement contrastografico a livello dello spazio intervertebrale consente di arrivare alla diagnosi corretta. Tuttavia, la presenza di elevata intensità di segnale nelle immagini T2 pesate e l’enhancement contrastografico sono apprezzabili fino al 30% dei casi (22), rendendo più difficile la differenziazione fra la SAPHO e la spondilodischite infettiva. La diagnosi differenziale della sindrome SAPHO rispetto alla spondilodiscite infettiva può essere ancora più difficile, se coesiste una tumefazione dei tessuti molli in sede prevertebrale. I segni radiologici del coinvolgimento spinale in corso di SAPHO possono includere una lesione osteolitica con collasso parziale o completo del corpo vertebrale, in assenza di traumi importanti. La flogosi a livello del corpo vertebrale, definita osteite, può coinvolgere la corticale, la cavità midollare o entrambe. Anderson et al. (12,23) hanno riportato all’esame RM una immagine lineare, simile ad una linea di frattura, in sede subcondrale, adiacente alle limitanti somatiche, circondata da edema midollare, ed associata al collasso, con aspetto della vertebra plana o del corpo vertebrale parziale in alcuni pazienti giovani. L’osteosclerosi di uno o più corpi vertebrali può essere riscontrata nei pazienti con SAPHO (17,18) La sclerosi del corpo vertebrale è di solito adiacente alle erosioni a livello delle limitanti somatiche e può progredire diventando diffusa e generalizzata, simile a “una vertebra d’avorio”, con sviluppo di iperostosi in casi più cronici (24). Iperostosi e osteite appaiono alla radiografia e alla TC come osteosclerosi con o senza aree di osteolisi (17,18). La RM, tuttavia, non può essere utilizzata per valutare la multifocalità. La RM whole body, con sequenze coronali pesate T1 e STIR, è sempre più utilizzata per la valutazione delle lesioni ossee multifocali e per il follow-up.
MODIC TIPO 1
Le alterazioni di Modic sono alterazioni patologiche delle limitanti somatiche vertebrali e del midollo osseo ad esse adiacente evidenziabili alla RM. Ne sono descritti di tre tipi (25). Il tipo I (M1, bassa intensitàdi segnale nelle immagini T1 pesate e alta intensità nelle immagini T2 pesate e T1 pesate dopo somministrazione di gadolinio) èconsiderato l’alterazione piùprecoce ed espressione del processo infiammatorio acuto ed èassociato alla presenza di tessuto fibrovascolare e all’edema osseo intraspongioso in sede subcondrale. Il tipo II (M2, alta intensitàdi segnale sia nelle immagini T1 che T2 pesate) riflette una sostituzione adiposa del midollo rosso; sono anche state segnalate forme intermedie tra il tipo I e II, in relazione alla conversione delle alterazioni di Modic da un tipo all’altro, rappresentando differenti stadi dello stesso processo patologico. Il tipo III (M3, bassa intensitàdi segnale sia nelle immagini T1 che T2 pesate) ècostituito da osso sclerotico (Figura 4).
A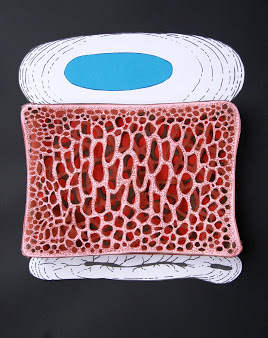 B
B 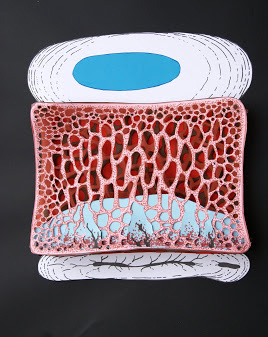 C
C 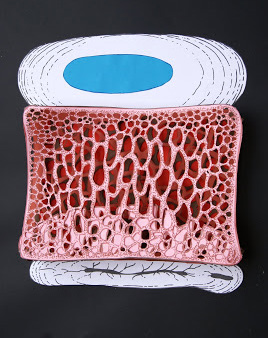
Figura 4. Alterazioni di MODIC. Nel TIPO 1 di MODIC (A) è possibile evidenziare una riduzione del segnale RM in T1 ed un aumento dell’intensità del segnale in T2 che sono indice di edema del tessuto spongioso associato a possibili fratture delle trabecole e vengono considerate considerati elementi di “attività”. Il TIPO 2 (B) e 3 (C) di MODIC indicano alterazioni di tipo cronico. Il TIPO 2 è caratterizzato da un aumento del segnale RM in T1 e un segnale ipointenso o aumentato in T2. Il midollo osseo è sostituito da tessuto adiposo che si infiltra fra le trabecole fratturate ed ispessite. ll TIPO 3 si presenta con una riduzione dell’intensità del segnale sia in T1 che in T2 ed è espressione di sclerosi ossea.
Gli aspetti in RM correlati al Modic di tipo 1, con ipointensità di segnale nelle sequenze T1 pesate e iperintensità nelle sequenze T2 pesate, possono talora porre problemi di diagnosi differenziale con le manifestazioni correlate alle axial-SpA. La diagnosi differenziale può essere fatta sulla base della mancanza di un segnale alterato o di ipointensità del disco nelle immagini T2 pesate, caratteristico di questo stadio infiammatorio dell’osteoartrite rispetto alle axial-SpA. La degenerazione del disco intervertebrale è caratterizzata da una graduale disidratazione del materiale del disco e si manifesta alla RM come perdita della normale iperintensità del nucleo polposo nelle sequenze T2, con conseguente perdita di altezza del disco. Tuttavia, un disco gravemente degenerato mostra occasionalmente un segnale iperintenso nelle sequenze T2 pesate. In tali casi, può essere difficile da distinguere dalla spondilodiscite piogenica. Le modificazioni tipo Modic 1 sono più spesso localizzate a livello L4/L5 e L5/S1 e sono state associate a dolore a carattere infiammatorio prevalentemente notturno, accompagnato da rigidità mattutina. L’infiammazione locale e sistemica può svolgere un ruolo importante nella genesi della lesione di Modic 1 e dei sintomi correlati. Alcuni autori hanno ipotizzato che le alterazioni di Modic 1 possono essere secondarie ad una infezione locale da germi anaerobi (26). In molti pazienti, la diagnosi corretta dell’infezione può essere fatta sulla base dei risultati clinico-laboratoristici e dell’imaging e della positività delle colture ematiche o bioptiche.
DISCITE CALCIFICA ACUTA SINTOMATICA
Nel paziente pediatrico la calcificazione idiopatica del disco intersomatico, nota anche come “discite calcifica” giovanile, costituisce una patologia rara, ad eziologia incerta, segnalata incidentalmente nel 5% delle radiografie del torace e nel 6% delle radiografie addominali e nel 70% degli esami post mortem degli adulti (26). L’eziologia della malattia èancora poco chiara cosìcome i meccanismi patogenetici; probabilmente ha un movente flogistico e l’evento traumatico èstato indicato come fattore scatenante. Cause note di calcificazione del disco intervertebrale dell’adulto, quali l’iperparatiroidismo, l’emocromatosi, l’alkaptonuria e l’ocronosi non sono implicate in questa patologia, cosìcome non vi èalcuna prova che tale patologia possa essere correlata ad un difetto metabolico. La calcificazione idiopatica del disco intersomatico si realizza a livello del nucleo polposo, risparmiando il legamento anulare (27) e puòriscontrarsi in tutti i segmenti rachidei anche se èpiùfrequente nel tratto cervicale, seguito da quello toracico e più raramente d quella lombare (28). Il numero dei dischi calcifici èvariabile (da 1 a 12) (29). L’esordio èsolitamente brusco ed ècaratterizzato da cervicalgia, torcicollo e limitazione funzionale ai movimenti. Raramente èdescritta disfagia. La febbre si manifesta in circa il 23% dei pazienti. Un incremento significativo della formula leucocitaria e della VES èstato osservato raramente. In circa il 30-40% dei casi èriferita una anamnesi prossima conseguente ad evento traumatico che orienta verso una eziologia traumatica di possibile natura ischemica e nel 15% una infezione delle vie respiratorie superiori, con un periodo di latenza compreso fra 5 giorni e 3 settimane (1). L’imaging gioca un ruolo fondamentale nella diagnosi della discite calcifica. La RM mostra tipicamente una lesione focale centrale a basso segnale nel disco su sequenze sia T1 che T2 pesate (30). Può essere evidenziato anche un rigonfiamento del disco, che può causare un’erniazione del disco stesso attraverso la limitante somatica del corpo vertebrale. La discite calcifica precoce può non essere radiograficamente evidente e un disco edematoso gonfio alla RM può essere l’unico indizio di discite calcifica; quindi, la RM può essere in grado di rilevare cambiamenti nel disco prima della calcificazione evidenziabile radiograficamente. Spesso può evidenziarsi un edema osseo a livello del corpo vertebrale adiacente al disco, di tipo reattivo, che può essere diffuso. Se il disco intervertebrale calcifico ernia all’interno del corpo vertebrale, il corpo verterbrale può andare incontro ad un processo infiammatorio e presentare enhancement contrastografico alla RM con mezzo di contrasto (31). In caso di spondilodiscite si può osservare un riassorbimento osseo, dovuto all’attività osteoblastica (31).
GOTTA VERTEBRALE
La gotta è una malattia metabolica caratterizzata da iperuricemia e deposizioni anomale di urato in diversi tessuti, più frequentemente a livello delle articolazioni periferiche degli arti superiori e inferiori, tipicamente nella prima articolazione metatarso-falangea. La gotta cronica tofacea è caratterizzata dai tofi, dalle erosioni e dalla sinovite cronica granulomatosa. I tofi sono costituiti da depositi di cristalli di urato monosodico (UMS) circondati da una matrice amorfa inter-cristallina e da tessuto di granulazione. Alcuni studi hanno evidenziato la deposizione di cristalli di UMS a livello del rachide, come una rara manifestazione della gotta (32). Può essere coinvolto qualsiasi segmento della colonna vertebrale e dei suoi componenti (corpi vertebrali, pedicoli, lamina, legamenti, cartilagine interapofisaria, spazi epidurali e intradurali), con il coinvolgimento lombare che è il più comune [80%] (33). I sintomi clinici della gotta spinale sono vari e aspecifici e possono variare dal mal di schiena a vari deficit neurologici. Pertanto, ci sono alcune difficoltà nella diagnosi della gotta spinale. La gotta che coinvolge le limitanti somatiche di due corpi vertebrali contigui e il disco intervertebrale è rara, e spesso all’imaging può mimare le forme degenerative e le spondilodisciti infettive (33). I tofi spinali possono comportare varie manifestazioni cliniche come il mal di schiena, la compressione del midollo spinale, la radicolopatia e sintomi clinici legati alla presenza di un ascesso epidurale e della spondilodiscite. La diagnosi di gotta spinale topacea è estremamente difficile e il test più accurato per confermare la sua diagnosi è l’esame istologico con agobiopsia. I risultati della radiografia convenzionale sono aspecifici e, a volte, appaiono come falsi negativi, soprattutto nelle fasi iniziali (34). I tofi sono ben apprezzabili nelle immagini TC, grazie al loro tipico valore di attenuazione [34,35). La tomografia computerizzata a doppia energia (DECT) è una tecnica di imaging innovativa, il cui utilizzo ha avuto un progressivo interesse nell’ ultimo decennio, giocando un ruolo fondamentale nello studio della gotta. Numerosi studi hanno dimostrato la sua una elevata capacità di rilevare i depositi di cristalli di MSU e nel differenziare la gotta da altre forme di artrite da precipitazione di cristalli (36,37). Grazie alla sua elevata sensibilità e specificità rispetto alle altre tecniche di imaging (38), nel 2015 l’American College of Rheumatology (ACR) e l’European League Against Rheumatism (EULAR) hanno introdotto la DECT nei criteri classificativi della gotta (39). La DECT consente la diretta visualizzazione dei cristalli di UMS, di rappresentarli mediante mappe colorimetriche e di calcolare il volume della deposizione, mediante software dedicati. Pertanto, la DECT appare di particolare utilità dal punto di vista diagnostico nei pazienti con una diagnosi non chiara o con manifestazioni cliniche atipiche (36,37). La RM può rilevare la presenza dei depositi tofacei e le erosioni in una fase precoce, quando sono ancora clinicamente silenti. Come in radiografia anche in RM, è possibile visualizzare le tipiche alterazioni erosive marginali e para-articolari della gotta. La RM può inoltre evidenziare come lo spessore della cartilagine articolare sia conservato a livello delle articolazioni colpite. I tofi presentano nelle sequenze T1-pesate una intensità di segnale intermedio-bassa, simile a quella dei muscoli. Nelle immagini T2-pesate il pattern RM dei tofi varia da un’omogenea alta intensità di segnale ad un aspetto eterogeneo con bassa intensità di segnale. L’intensità di segnale nelle immagini T2-pesate può essere eterogenea in relazione alla presenza di UMS o alla deposizione di sali di calcio, emosiderina e tessuto fibroso. In particolare, le caratteristiche dei tofi spinali, alla RM, appaiono come aree omogenee di intensità di segnale da media a bassa intensità nelle immagini T1 pesate. Nelle immagini T2 pesate, l’intensità del segnale del tofo varia da un’iperintensità omogenea ad un’ipointensità omogenea. Questa iperintensità può risultare da un aumento relativo del contenuto d’acqua del tofo. Foci di bassa intensità di segnale possono essere visti nelle immagini ottenute con tutte le sequenze; questo aspetto può essere dovuto a calcificazioni, tessuto fibroso maturo, o alla deposizione di emosiderina nel tofo (40). La RM consente, inoltre, di differenziare i tofi da altre lesioni nodulari dei tessuti molli e può dimostrare alcune complicanze della gotta cronica, come le neuropatie compressive, mediante la visualizzazione diretta delle sedi anatomiche di compressione nervosa. Il pattern di enhancement dei tofi dopo somministrazione endovenosa di mezzo di contrasto paramagnetico varia da un quadro di intenso enhancement omogeneo ad uno eterogeneo e periferico. Le sequenze STIR e quelle a soppressione del segnale del tessuto adiposo possono, inoltre, dimostrare l’edema osseo midollare intraspongioso, che può essere presente nella gotta in relazione alle erosioni ed alla sinovite, ma anche alla sola presenza di tofi (40). Le seguenti caratteristiche sono ritenute utili per differenziare questa condizione dalla spondilite infettiva: (i) l’associazione con la spondilolistesi dovuta alle erosioni della parte interarticolare e a livello delle faccette articolari; (ii) erosioni a margini lisci a livello della limitante somatica inferiore di L5, piuttosto che ad un aspetto destruente irregolare; e (iii) la normale intensità del segnale della midollare ossea a livello delle vertebre adiacenti, non apprezzabile generalmente in corso di spondilite infettiva.
SPODILOARTROPATIA DISTRUTTIVA DELL’EMODIALIZZATO CRONICO
La spondiloartropatia distruttiva (DSA) è stata sempre più spesso segnalata come una grave complicazione dell’emodialisi a lungo termine. La DSA è riportata nell’8%-18% dei pazienti dializzati (41). Uno o più livelli della colonna vertebrale possono essere coinvolti e le lesioni possono interessare corpi vertebrali contigui o lontani. L’interessamento della regione occipito-atlanto-assiale è raro (29). La DSA è una diagnosi radiografica basata sulla triade di grave restringimento degli spazi intervertebrali, erosioni e lesioni di tipo cistico a livello delle limitanti somatiche dei corpi vertebrali adiacenti, e l’assenza di osteofitosi significativa (42). Le manifestazioni cliniche della DSA sono variabili; i pazienti possono essere asintomatici o avere un dolore invalidante o parestesie e, in rari casi, una sintomatologia da compressione midollare. La cerviconucalgia rappresenta la manifestazione clinica più frequente (43). Si ritiene che la DSA sia strettamente associata ad un’amiloidosi sistemica, correlata all’emodialisi, in cui la beta2-microglobulina (β2-m) è stata identificata come il principale componente delle fibrille amiloidi depositate. Diversi fattori, quali la durata dell’insufficienza renale, l’età di esordio, la durata dell’emodialisi e i parametri clinici sono stati identificati come fattori di rischio di sviluppo della DSA (44), sebbene la storia naturale della malattia e il piano terapeutico più efficace sono poco noti. In considerazione del fatto che i pazienti con insufficienza renale cronica allo stadio terminale, specialmente quelli in trattamento dialitico cronico, hanno un maggior rischio di andare incontro ad infezioni da Stafilococco, la diagnosi differenziale fra le alterazioni al rachide legate all’emodialisi e le spondilite infettive appare di particolare importanza (1). La RM è superiore alla radiologia convenzionale nell’escludere un processo infettivo (45). Alla RM generalmente il tratto vertebrale coinvolto presenta una bassa intensità di segnale nelle sequenze T2 pesate, sebbene alcuni autori abbiano riportato un’alta intensità di segnale delle strutture interessate nelle sequenze T2 pesate (46). Tuttavia, la bassa intensità di segnale nelle immagini T2 pesate in T2 aiuta generalmente ad escludere la diagnosi di un’infezione. Con la progressione della malattia, può verificarsi il collasso di un corpo vertebrale e l’instabilità spinale (46).
Spondilodiscite infettiva
La spondilodiscite è di solito un’infezione batterica dovuta ad un solo agente microbico. Gli agenti patogeni più frequentemente responsabili sono: Staphylococcus aureus, Enterobacter, Escherichia coli, Salmonella, Pseudomonas aeruginosa, Klebsiella pneumoniae. Lo Staphylococcus aureus è l’agente più frequente, responsabile di circa la metà dei casi di spondiloscite non tubercolare. L’infezione può propagarsi per via ematogena, per contiguità, per inoculazione diretta (interventi chirurgici, ferite aperte). L’età dei pazienti è per lo più tra i 60 e i 70 anni (1). Pazienti immunocompromessi presentano un rischio più alto di infezione. La localizzazione più frequente è a livello lombare, seguita da quella toracica, cervicale e infine sacrale. Nei bambini l’infezione interessa inizialmente il disco intervertebrale e nelle fasi più avanzate si diffonde ai piatti vertebrali e ai corpi vertebrali; negli adulti, causa la scarsa vascolarizzazione dei dischi intervertebrali, l’infezione interessa inizialmente la parte subcondrale dei corpi vertebrali. Il quadro clinico è estremamente variabile; di norma il paziente accusa dolore locale; la febbre non è costante; la velocità di eritrosedimentazione è di norma elevata; la presenza di sintomi neurologici deve fare sospettare la diffusione dell’infezione allo spazio epidurale (47). Gli organismi responsabili delle infezioni granulomatose sono il Mycobacterium tuberculosis (cioè la malattia di Pott) e la Brucella. Le infezioni fungine sono estremamente rare, per lo più responsabili di infezioni opportunistiche in individui immunocompromessi. Allo stesso modo, l’infezione della colonna vertebrale echinococcica è abbastanza rara, per lo più descritta in aree endemiche (1,47).
SPODILODISCITE DA PIOGENI
Il microrganismo più frequentemente implicato è lo Staphilococcus aureus. La via di propagazione è, di norma, ematogena, da un focolaio cutaneo, polmonare o delle vie urinarie. Come già detto, è anche possibile l’estensione dell’infezione per contiguità a partire da un focolaio osteomielitico. Talora, l’infezione ha un carattere iatrogeno (iniezioni o infusioni epidurali, anestetiche e/o analgesiche). L’infezione può interessare qualunque segmento e di norma si estende per più metameri (in un terzo dei casi più di 6); la localizzazione è più frequentemente posteriore. Il quadro clinico, nelle fasi iniziali, non è specifico; i pazienti presentano febbre, elevazione della velocità di eritrosedimentazione. Condizioni predisponenti sono il diabete, il consumo di droghe, i traumi, le malattie debilitanti (1,48,49).
Altri microorganismi, potenzialmente coinvolti sono lo Staphylococcus epidermidis, l’Haemophilus influenzae, l’Enterococcus spp, ed altri differenti ceppi di Streptococcus (Figura5).
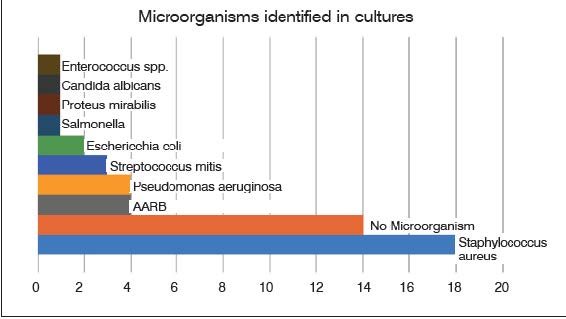
Figura 5. Microrganismi identificati nelle culture di materiale chirurgico
Lo Staphylococcus epidermidis è la specie più frequentemente identificata ed è associata a ad endocardite e alle infezioni post-operatorie. Gli streptococchi (streptococchi di tipo viridans e streptococchi emolitici b-emolitici, in particolare i gruppi A e B) e gli enterococchi sono altre cause di spondilodiscite (5%-20%) (47). Fra i germi gram-negativi l’Escherichia coli è il germe più frequentemente isolato; gli altri principali agenti causali di questo gruppo sono il Proteus, la Klebsiella e l’Enterobacter spp. e la Salmonella enterica. L’infezione da Salmonella è più comune nei pazienti con malattia falciforme. Le specie di Pseudomonas sono gli agenti causali più comuni nei tossicodipendenti per via endovenosa. La presentazione clinica dell’osteomielite può essere variabile, ma i segni tipici sono dolori al rachide focale e spasmi muscolari, presenti in più del 90% dei casi (50). La febbre e la leucocitosi sono presenti solo dal 40% al 50% dei casi.
La velocità di eritrosedimentazione e la proteina C-reattiva sono quasi sempre incrementate (51). La colonna lombare è la più frequentemente colpita (48%), seguita da quella toracica (35%) e cervicale (6.5%) (52). La coesistenza di una discite può aiutare a distinguere un ascesso da un tumore metastatico. La discite precede tipicamente la formazione di ascessi, mentre un tumore metastatico coinvolge l’osso, ma non interessa il disco. La RM è risultata la tecnica più sensibile nella caratterizzazione dell’osteomielite; tuttavia, nonostante sia lo strumento più sensibile per individuare l’osteomielite precoce, la positività alla RM può essere più tardiva rispetto alla comparsa dei sintomi clinici. Il follow-up ad 1 anno con RM può essere utile per la valutazione dell’evoluzione del processo infettivo.
Malattie granulomatose infettive
Un’infezione granulomatosa della colonna vertebrale è caratterizzata da un processo infettivo nel contesto degli elementi spinali che si traduce nella formazione di un granuloma, costituito da macrofagi tra-sformati, cioè, cellule epitelioidi, matrice e altre cellule infiammatorie (53). Gli agenti responsabili includono vari batteri, funghi o altri parassiti; tuttavia, quelli più frequentemente riscontrati sono il Mycobacterium tu-berculosis (o malattia di Pott) e la Brucellosi. L’insor-genza di queste infezioni è spesso insidiosa e porta ad un ritardo nella diagnosi. Quando non trattato, que-sto processo infiammatorio può portare ad alterazioni osteo-strutturali della colonna vertebrale, con conse-guente deformità spinale e conseguente compressione degli elementi neurali.
SPODILODISCITE TUBERCOLARE
Rappresenta la più comune infezione granuloma-tosa che interessa il tessuto osseo. Può essere secondaria a una localizzazione polmonare o primitiva. E’ più frequentemente riportata in pazienti di età inferiore ai 20 anni. Fattori predisponenti sono l’immunodepressione, l’alcolismo, la debilitazione. La localizzazione più comune è a livello delle ultime vertebre dorsali e delle vertebre lombari. Particolarmente frequente (dal 55 al 95% dei casi) è la formazione di ascessi paraspinali, anche di notevoli dimensioni, spesso con calcificazioni. Il quadro clinico è sfumato ed insidioso, caratterizzato da vaghi dolori rachidei; l’evoluzione è meno severa della spondilodiscite da piogeni. La presentazione clinica della tubercolosi è insidiosa, con insorgenza di sintomi che vanno da mesi a 2 o 3 anni (54). Il dolore lombare (back pain), è spesso associato (nel 80% dei casi) a rigidità vertebrale e spasmi dolorosi della muscolatura paravertebrale (55), e dalla debolezza delle estremità inferiori, riscontrata fino al 73% dei pazienti (55). Il dolore può essere aggravato dal movimento della colonna vertebrale, dalla tosse e dal peso, a causa di un’avanzata rottura del disco e instabilità della colonna vertebrale, compressione della radice del nervo o frattura patologica. Torcicollo, dolore cervicale, rigidità, rigidità, disfagia e/o stridore inspiratorio sono le manifestazioni cliniche più frequenti nella colonna vertebrale cervicale. La deformità cifotica della colonna vertebrale si verifica come conseguenza del collasso degli elementi spinali anteriori ed è più frequente nelle vertebre toraciche che in altre localizzazioni della colonna vertebrale. Il restringimento dello spazio inter-somatico si verifica secondariamente e non è così evidente come nell’infezione piogenica. L’incidenza riportata di deficit neurologico nella tubercolosi spinale varia dal 23 al 76% (56). Nel più grande studio epidemiologico della spondilodiscite fino ad oggi, il coinvolgimento spinale nella tubercolosi era significativamente più comune nei pazienti di età inferiore ai 40 anni rispetto a quelli di età superiore ai 40 anni (57). Quando la diagnosi viene posta in fase tardiva, la tumefazione dei tessuti molli può essere apprezzabile all’esame obiettivo. La deformità cifotica della colonna vertebrale si verifica come conseguenza del collasso degli elementi spinali anteriori ed è più frequente a livello delle vertebre toraciche che in altre localizzazioni della colonna vertebrale. La tubercolosi spinale inizia di solito nella parte antero-inferiore del corpo vertebrale. La diffusione dell’infezione può avvenire sotto il legamento longitudinale anteriore che coinvolge i corpi vertebrali adiacenti. Il restringimento dello spazio del disco si verifica secondariamente e non è così evidente come nell’infezione piogenica. La mancanza di enzimi proteolitici nel Mycobacterium rispetto all’infezione piogenica è stata proposta come causa della relativa conservazione del disco intervertebrale (58). La RM rappresenta la tecnica gold-standard per la diagnosi di tubercolosi spinale ed è più sensibile dell’esame radiografico e più specifica della TC. La RM consente la valutazione del coinvolgimento neurologico, evidenzia l’interessamento dei corpi vertebrali, la distruzione del disco, le raccolte ascessuali, il collasso vertebrale e le deformità spinali. Il disco può non mostrare un aumento del segnale nelle sequenze T2 pesate, al contrario di quanto avviene nelle infezioni piogeniche (59). Il coinvolgimento degli elementi posteriori è più comune nella tubercolosi rispetto all’infezione da piogeni (60) e questo può rendere difficile la diagnosi differenziale fra l’infezione e la neoplasia, soprattutto quando c’è una relativa conservazione del disco intervertebrale. Nella tubercolosi, l’infezione si diffonde comunemente ai legamenti adiacenti e ai tessuti molli paravertebrali, con una variabilità dal 55% al 96% dei casi. La diffusione di solito avviene in sede anterolaterale. Il flemmone paravertebrale è caratterizzato da uno spesso ed irregolare enhancement contrastografico alla RM e alla TC. Il rim di enhancement contrastografico degli ascessi intraossei e nei tessuti molli paravertebrali è più comune nelle forme tubercolari rispetto ad altre infezioni. Le raccolte paraspinali sono generalmente più larghe nella tubercolosi rispetto all’infezione da piogeni. Caratteristico è il collasso di corpi vertebrali, parzialmente distrutti, con conseguente deformità a gibbo. La giunzione toraco-lombare è il segmento spinale più frequentemente colpito. Il coinvolgimento dei segmenti cervicale e sacrale della colonna vertebrale è relativamente poco frequente.
SPODILODISCITE DI BRUCELLA
Il coinvolgimento osteoarticolare in corso di infezione da brucella è la manifestazione piu’ frequente e viene riportata nel 10% – 85% dei pazienti infetti (61). La contaminazione avviene per ingestione di latte infetto (62). Si localizza a livello del rachide lombare, ha evoluzione acuta e il quadro neuroradiologico non è distinguibile da quello della tubercolosi. Le sedi più frequentemente colpite sono le vertebre lombari (60%), sacrali (19%) e cervicali (12%) (63). Il dolore al rachide rappresenta la più comune manifestazione in corso brucellosi, con coinvolgimento spinale (64) ed è riferito in circa la meta’ dei casi. Alcuni pazienti con brucellosi spinale, che presentano lombalgia e sciatalgia, vengono erroneamente diagnosticati come affetti da malattia del disco intervertebrale e sottoposti ad intervento chirurgico. La RM rappresenta la tecnica gold-standard per la diagnosi di spondilodiscite, per la visualizzazione dell’ascesso epidurale e della compressione del midollo o sulle radici nervose, in corso di brucellosi (63). La spondilodiscite può manifestarsi con un coinvolgimento in sede/focale o multi-focale. Il coinvolgimento multifocale a livello del rachide è stato osservato nel 3%-14% dei pazienti] (65). Alla RM si evidenziano caratteri distruttivi a carico dello spigolo antero-superiore dei corpi vertebrali, associati ad evidente osteosclerosi, che rappresenta un segno patognomonico dell’infezione (66). Si può manifestare come una discite, con il solo coinvolgimento del disco, senza interessamento dei corpi vertebrali. L’ascesso epidurale rappresenta una rara evenienza, ma può decorrere associato a severe complicanze, quali deficit neurologici permanenti o, perfino, alla morte, se non trattato precocemente.
Infezioni fungine vertebrali
La spondilodiscite fungina non è evenienza comune (0,5%-1,6%). L’incidenza di infezioni fungine è aumentata nell’ultimo decennio, con l’incremento dei pazienti immunocompromessi (67). Candida spp., Aspergillus spp. e Cryptococcus neoformans sono presenti in tutto il mondo, mentre i funghi dimorfi Coccidioides immitis e Blastomyces dermatitidis sono endemici in alcune aree geografiche. La Candida albicans è la specie di Candida più comunemente segnalata in letteratura. I fattori di rischio sono rappresentati dall’uso di antibiotici ad ampio spettro e di dispositivi di accesso venoso centrale. Le manifestazioni di infezione fungina nella colonna vertebrale includono la discite, l’osteomielite e la meningite. Questi agenti patogeni possono portare alla formazione di ascessi e granulomi. La discite è comune nei bambini, a causa della persistente vascolarizzazione del disco vertebrale e l’infezione si estende poi alle vertebre adiacenti, manifestandosi, quindi, con le tipiche lesioni della spondilodiscite.
A differenza delle infezioni da piogeni, nelle infezioni fungine, come in quelle tubercolari gli elementi vertebrali posteriori sono frequentemente coinvolti (68). Un’estesa distruzione vertebrale può causare deformità, compromettere la stabilità o causare la compressione del midollo spinale. Un’infezione non trattata può portare alla formazione di ascessi paravertebrali o può diffondersi nel canale vertebrale. Tale contaminazione può provocare meningite, formazione di ascessi epidurali o subdurali, compromissione neurologica ed elevati tassi di morbilità e mortalità (69).
CANDIDA
Anche se ci riconoscono almeno 10 specie di Candida patogene per l’uomo, il 62% dei casi di osteomielite vertebrale sono causati dalla Candida albicans, il 19% dalla Candida tropicalis, e il 14% dalla Candida glabrata (precedentemente denominata Torulopsis glabrata). complesso, la Candida è responsabile di circa lo 0,7% – 2,7% dell’infezione spinale (70). Il rachide dorsale distale e la colonna lombare sono i tratti più frequentemente coinvolti (95% dei pazienti), con soli pochi casi riportati di coinvolgimento spinale più craniale e di un solo caso pubblicato di coinvolgimento del sacro (71). Nell’ 83% dei casi i pazienti riferiscono mal di schiena da più di 1 mese, come manifestazione di esordio; solo il 32% ha febbre (72).
ASPERGILLUS
La specie più frequentemente isolata nella specie umana è l’Aspergillus fumigatus. La regione lombare è il distretto articolare più frequentemente coinvolto (63%), seguito dalla tibia, le coste, il polso, lo sterno, la pelvi e il ginocchio (73). L’osteomielite vertebrale da Aspergillus presenta molte caratteristiche in comune con quella da piogeni. Esse includono distribuzione bimodale per l’età, prevalenza per il sesso maschile, prevalente coinvolgimento lombare e dolore al rachide (74). Back pain has been reported almost consistently as the initial complaint with this infection (74).
CRYPTOCOCCUS
L’infezione da Cryptococcus è la più comune, con coinvolgimento del sistema nervoso centrale negli animali. L’interessamento osseo si verifica circa dal 5% al 10% nei pazienti adulti e si manifesta con ascessi freddi, simili a quelli della tubercolosi (75). Le vertebre rappresentano la sede più frequentemente colpita dall’osteomielite da Cryptococcus, ed in particolare il rachide lombare è il tratto più colpito, seguito da quello cervicale (75).
COCCIDIOIDOMYCOSIS
È un’infezione sistemica causata da Coccidioides immitis e le manifestazioni ossee si osservano dal 10% al 50% dei pazienti affetti da malattia disseminata (76). Le sedi più frequentemente colpite sono il rachide, le coste e la pelvi, sebbene ogni segmento scheletrico possa essere colpito (77). Il processo osteomielitico può interessare uno o più corpi vertebrali, i tessuti molli paravertebrali e le coste contigue. I dischi intervertebrali sono relativamente risparmiati, e il collasso dei corpi vertebrali e la formazione di tramiti fistolosi sono manifestazioni tardive, non comuni. A differenza della tubercolosi, la deformità a gibbo non sono frequenti, ma è stata riportata (78). I reperti alla RM non sono specifici e la diagnosi viene fatta mediante esame bioptico in un paziente proveniente da un’area endemica.
BLASTOMYCOSIS
Il coinvolgimento scheletrico è stato riportato dal 10 % al 60% delle forme cliniche a carattere disseminate. Il rachide è la sede più frequentemente colpita, seguita dal cranio, le coste, la tibia e le ossa del piede e della mano (79). Come nella tubercolosi, il tratto dorsale distale e il rachide lombare sono le sedi più frequentemente colpite. La porzione anteriore del corpo vertebrale di solito è interessata nelle fasi iniziali. La successiva distruzione ossea può portare alle fratture vertebrali e alla diffusione ai corpi vertebrali adiacenti attraverso i dischi intervertebrali. Corpi vertebrali non adiacenti possono essere coinvolti dalla diffusione dell’infezione lungo il legamento longitudinale anteriore. Ciò può condurre alla formazione di ascessi a livello dei muscoli psoas o dei tessuti molli paravertebrali, con deformità del rachide (80).
Spondilodisciti parassitarie
Una percentuale non trascurabile di infezioni parassitarie che colpiscono il sistema nervoso centrale (SNC) possono coinvolgere anche la colonna vertebrale. La più comune di queste malattie è la cisticercosi. Nelle regioni endemiche, la schistosomiasi è una causa comune di interessamento del midollo spinale. La toxoplasmosi è un agente patogeno frequentemente riscontrato nei pazienti immunocompromessi, in particolare nei pazienti affetti da sindrome da immunodeficienza acquisita (AIDS). L’echinococcosi e l’idatidosi sono anche malattie parassitarie emergenti in alcune parti del mondo. Anche se la diagnosi definitiva di una parassitosi spinale è solitamente confermata dalla biopsia e dall’esame istologico, il sospetto clinico si basa, generalmente, su una combinazione di caratteristiche etniche, cliniche, sierologiche e dell’imaging. I pazienti possono presentare sintomi tipici, come lombalgia cronica, intorpidimento, debolezza o incontinenza intestinale / vescicale.
CYSTICERCOSIS
La cisticercosi è la più comune infezione parassitaria con interessamento del SNC ed è causata dalla Taenia solium (81). Il coinvolgimento spinale in corso di cisticercosi è molto raro, ed è riportato in circa l’1- 6% dei pazienti con infezione da cistercosi ed interessamento neurologico (81). A causa dell’effetto di massa e dello spazio limitato all’interno del canale midollare, rispetto allo spazio intracranico, la cisticercosi spinale, può provocare una compromissione neurologica. I deficit neurologici sono secondari all’effetto di massa delle cisti e alla reazione infiammatoria.
SCHISTOSOMIASI
La schistosomiasi è un’infezione causata da platelminti (vermi piatti) del genere Schistosoma (82). Tre sono i principali organismi responsabili dell’infezione umana: Schistosoma japonicum, S. mansoni, e S. hematobium. L’infezione del midollo spinale è spesso causata dallo S. mansoni e S. hematobium, mentre lo S. japonica è responsabile nella maggior parte dei casi di interessamento cerebrale. Clinicamente, la schistosomiasi spinale tende a presentarsi acutamente o subacutamente e più spesso coinvolge il midollo spinale nel tratto diatale (83). Uno dei primi segni può essere il dolore lombare con irradiazione alle estremità inferiori. Altri sintomi associati includono debolezza e parestesie agli arti inferiori, disfunzione vescicale, anomalie dei riflessi tendinei profondi, costipazione e impotenza sessuale (83). La RM rappresenta la modalità di imaging di scelta per la diagnosi di schistosomiasi del midollo spinale. Un reperto comune che può essere osservato è l’allargamento del midollo spinale, in particolare nel tratto spinale inferiore e nella regione del conus medullaris (84). Questo è dovuto alla formazione di un granuloma intramidollare.
TOXOPLASMOSI
La toxoplasmosi è la più comune infezione opportunistica del SNC che colpisce principalmente i pazienti affetti da AIDS (85). La malattia è causata dal Toxoplasma gondii, che è un parassita protozoo intracellulare obbligato. I sintomi più comuni sono la debolezza delle estremità, la compromissione sensoriale, l’incontinenza e l’alterazione dei riflessi tendinei profondi (85, 86). Le lesioni presentano iperintensità di segnale nelle sequenze T2 pesate e rinforzo post-contrastografico. Le lesioni intramidollari che presentano un rim di enhancement contrastografico rappresentano un reperto RM di comune riscontro in corso di toxoplasmosi (86,87).
ECHINOCCOSI/IDATIDOSI
L’echinococcosi/idatidosi, causata da Echinococcus granulosus, è una zoonosi parassitaria comune che può coinvolgere fegato e polmoni. La malattia cistica idatidea dello scheletro è una delle manifestazioni cliniche più rare e quando si verifica coinvolge in quasi il 50% dei casi la colonna vertebrale (88). Le cisti idatidee spinali rappresentano l’1% di tutti i casi di malattia idatidea (89). La sede più comune per la cisti idatidea primaria intradurale extramidollare è toracica (46,5 %), lombare (30,2 %), cervicale (9,3 %) e poi toracolombare, cervico-dorsolombare e cervicodorsale. Le cisti si presentano in due modi, uniloculari e multiloculari. La cisti uniloculare è più comune (57,5%) (90). Braithwaite and Lees (91) hanno classificato il coinvolgimento spinale della malattia da idatidi in cinque gruppi: (1) cisti idatidea primaria intramidollare; (2) cisti idatidea intradurale extramidollare; (3) cisti idatidea extradurale intraspinale; (4) malattia idatidea delle vertebre; (5) malattia idatidea paravertebrale. I primi tre tipi di questo gruppo sono considerati rari. La tecnica di imaging di scelta è stata la RM. Nelle immagini T1-pesate, la parete della cisti può essere isointensa o con segnale leggermente più basso rispetto al suo contenuto, e nelle immagini T2-pesate pesate si evidenzia un bordo a bassa intensità di segnale con all’interno un contenuto omogeneo ad alto segnale, di aspetto cisti. Le immagini T2 pesate possono fornire preziose informazioni riguardo la vitalità della cisti: una diminuzione dell’alta intensità di segnale e un incremento della bassa intensità di segnale della parete della cisti collassata indicano una cisti in fase di quiescenza. La parete della cisti dimostra un leggero enhancement contrastografico. La bassa intensità di segnale del bordo della cisti è dovuta ad una fibrosi reattiva e a fenomeni degenerativi intorno alla membrana parassitaria e sono correlati ai reperti istopatologici (92).
Diagnosi differenziale
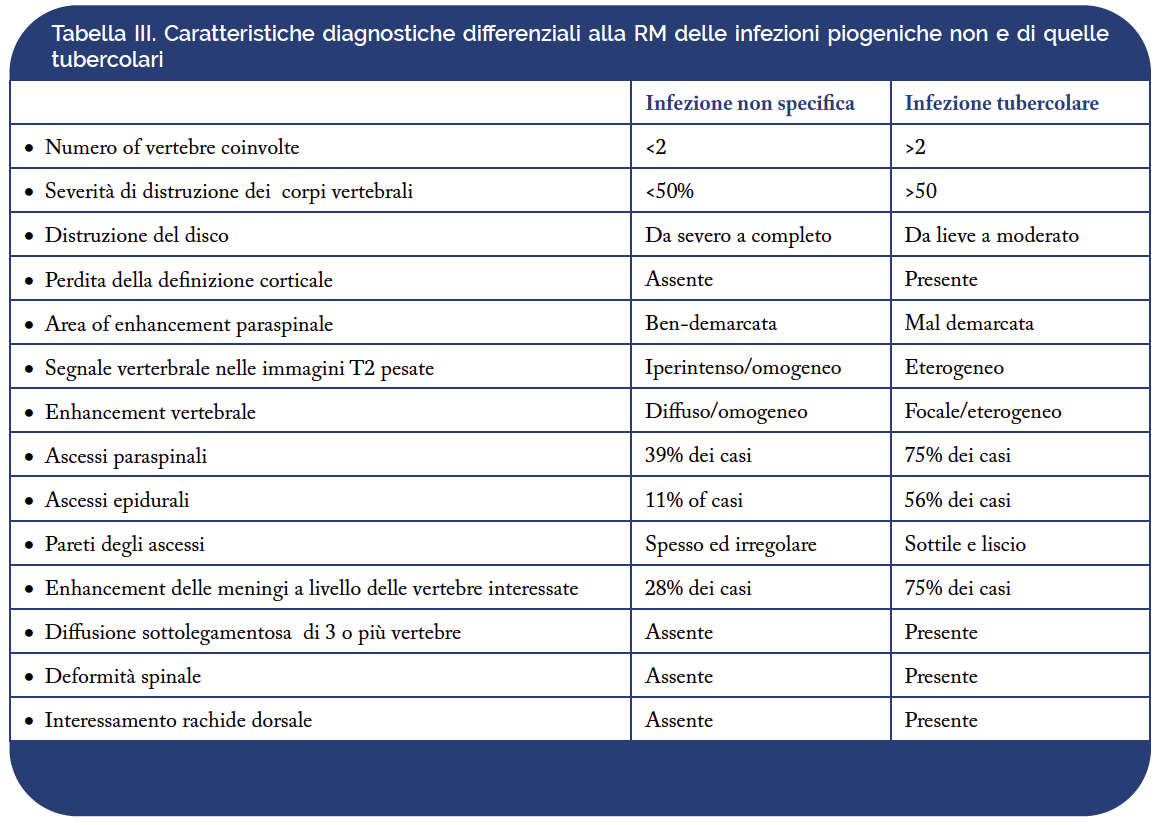
La diagnosi differenziale tra le malattie infiammatorie non infettive e non infettive della colonna vertebrale è sempre stata una ardua sfida per reumatologi e radiologi, a causa del decorso clinico equivoco e dei reperti non sempre caratteristici all’imaging. La RM consente, tuttavia, l’identificazione di alcuni segni semeiologici specifici delle spondilodisciti infettive. Le principali caratteristiche della infezione piogenica sono rappresentate dal coinvolgimento del rachide lombare, lo scarso enhancement contrastografico dei tessuti paravertebrali, il diffuso/omogeneo enhancement contrastografico dei corpi vertebrtali, che presentano scarsi fenomeni distruttivi, e segnale iperintenso/omogeneo dei corpi vertebrali nelle immagini T2 pesate. La spondilodiscite tubercolare è caratterizzata principalmente dalla relativa conservazione del disco intervertebrale e da altre caratteristiche, quali gli ascessi intraossei, estese raccolte ascessuali paravertebrali, diffusione sottolegamentosa, il coinvolgimento degli elementi posteriori e invasione del canale vertebrale e delle radici nervose. Nella spondilodiscite tubercolare, le dimensioni degli ascessi paraspinali appaiono solitamente più grandi di quelli delle forme brucellari. Il coinvolgimento degli elementi posteriori della colonna vertebrale, in particolare dei peduncoli vertebrali, non è generalmente una caratteristica della tubercolosi spinale. La colonna lombare superiore e la colonna toracica inferiore sono le sedi più frequentemente colpite. Più di una vertebra è tipicamente interessata, e i corpi vertebrali sono più frequentemente colpiti rispetto agli elementi posteriori. Un’architettura vertebrale quasi intatta si osserva nella spondilodiscite brucellare, nonostante l’evidenza di una diffusa infezione vertebrale. Caratteristico è anche un aumento dell’intensità del segnale del disco nelle immagini pesate in T2, così come il coinvolgimento delle faccette articolari. Gli ascessi paravertebrali tendono ad essere più piccoli di quelli delle infezioni tubercolari. Nella fase acuta (< 3 mesi) e subacute (3-12 mesi), la spondilodiscite brucellare può simulare la tubercolosi. In queste fasi, la più omogenea iperintensità di segnale nelle sequenze STIR e l’altezza vertebrale quasi conservata sembrano suggerire la diagnosi di spondilodiscite brucellare, piuttosto che tubercolare. La maggior parte delle infezioni fungine della colonna vertebrale non mostrano reperti specifici alla RM. La distruzione del corpo vertebrale in questo tipo di infezione può imitare la spondilite tubercolare. L’assenza di aumento del segnale nelle immagini T2 pesate e il basso o assente enhancement contrastografico dopo mdc. sono caratteristiche tipiche delle infezioni fungine. La RM può sovrastimare l’estensione del processo infettivo, pertanto, ulteriori informazioni potebbero derivare dalla radiologia convenzionale o dalla TC. La tabella III riassume le principali caratteristiche diagnostiche differenziali fra le spondilodisciti piogeniche e quelle tubercolari.
Conclusioni
Le spondilodisciti coinvolgono i corpi vertebrali e il disco intervertebrale e possono interessare le strutture paravertebrali ed il canale spinale. Se non riconosciute e trattate precocemente, la morbilità e la mortalità sono potenzialmente elevate. L’incidenza delle spondilodisciti è aumentata nel corso degli ultimi anni a causa dell’ incremento della popolazione immunodepressa, ma anche come conseguenza della miglior accuratezza diagnostica. Tuttavia, la diagnosi definitiva rimane impegnativa poiche la malattia può avere un’insorgenza insidiosa, con caratteristiche cliniche spesso non specifiche. La RM è la tecnica più sensibile per l’inquadramento diagnostico e prognostico di spondilodiscite. Permette la diagnosi in assenza di segni radiografici e può fornire indicazioni sull’agente eziologico. Tuttavia, la differenziazione dei vari sottotipi della spondilodiscite alla RM è difficile, in particolare quando non si possibile reperire reperti caratteristici o in caso di pattern aspecifici di presentazione del quadro clinico. Inoltre, le forme infiammatorie non infettive e quelle degenerative possono simulare un’infezione spinale. I limiti della RM restano, principalmente, la limitata disponibilità e la scarsa accessibilità alle apparecchiature ed il tempo di esecuzione dell’indagine.
Punti chiave
- La spondilodiscite è un’infiammazione localizzata a livello delle vertebre (spondilite) e dei dischi intervertebrali (discite), provocata da malattie infiammatorie o infettive, la cui diagnosi e gestione è ancora impegnativa.
- Le principali malattie infiammatorie che colpiscono la colonna vertebrale, comprendono le spondiloartriti (SpA), la sinovite-acne- pustulosi-iperostosi-osteite (SAPHO), la discopatia degenerativa “attiva” o MODIC di tipo 1, le calcificazioni discali da deposizione di cristalli di idrossiapatite (HADD), la gotta spinale (secondaria a deposizione di critalli di urato monosodico) e la sindrome spondiloartropatica distruttiva dell’emodiali.
- L’infezione vertebrale piogenica è la causa più comune della spondilodiscite, spesso di origine spontanea ed ematogena. Gli organismi maggiormente responsabili di tali infezioni sono i batteri patogeni gram-positivi ed i batteri gram-negativi, con una prevalenza accertata verso lo Staphilococcus Aures che causa circa il 50% dei casi, a seguire troviamo lo Streptococco, gli Stafilococchi coagulasi Negativi, gli Enterobatteri del tipo Escherichia Coli, lo Pseudomonas ed infine gli Enterococchi.
- La spondilodiscite è, inoltre, una complicanza frequente e importante delle infezioni granulomatose (come la tubercolosi e la brucellosi), delle infezioni fungine e di quelle parassitarie.
- Attualmente, la risonanza magnetica (RM) rappresenta la tecnica di prima scelta nella diagnosi delle spondilodisciti per la sua elevata sensibilità, specificitàe accuratezza diagnostica. La RM fornisce informazioni anatomiche dettagliate, soprattutto per lo studio dello spazio epidurale e del midollo spinale e potrebbe consentire la diagnosi differenziale valutando gli aspetti semeiologici caratteristici dei quadri patologici a carattere infiammatorio, infettivo e neoplastico.
Bibliografia
- Salaffi F, Ceccarelli L, Carotti M, Di Carlo M, Polonara G, Facchini G, Golfieri R, Giovagnoni A. Differentiation between infectious spondylodiscitis versus inflammatory or degenerative spinal changes: How can magnetic resonance imaging help the clinician? Radiol Med. 2021;126(6):843- 859.
- Hermann, K. G. et al. Descriptions of spinal MRI lesions and definition of a positive MRI of the spine in axial spondyloarthritis: a consensual approach by the ASAS/OMERACT MRI study group. Ann. Rheum. Dis. 2012;71, 1278–1288.
- Rudwaleit M, Landewé R, van der Heijde D, et al. The development of Assessment of SpondyloArthritis international Society classification criteria for axial spondyloarthritis (part I): classification of paper patients by expert opinion including uncertainty appraisal. Ann Rheum Dis 2009;68:770–6.
- Nguyen C, Poiraudeau S, Rannou F. From Modic 1 vertebral-endplate subchondral bone signal changes detected by MRI to the concept of ‘active discopathy’. Ann Rheum Dis. 2015;74(8):1488-1494.
- Hoenen-Clavert V, Rat AC, Loeuille D, et al. Inflammatory and structural evaluatin in spondyloarthritis: magnetic resonance imaging analysis of axial and peripheral involvement. J Rheumatol 2007;34:762–8.
- Butler JS, Shelly MJ, Timlin M, Powderly WG, O’Byrne JM. Nontuberculous pyogenic spinal infection in adults: a 12-year experience from a tertiary referral center. Spine 2006, 31(23):2695–2700.
- Bozgeyik Z, Ozdemir H, Demirdag K et al. Clinical and MRI findings of brucellar spondylodiscitis. Eur J Radiol 2008;67:153–158
- Maiuri F, Iaconetta G, Gallicchio B, Manto A, Briganti F. Spondylodiscitis. Clinical and magnetic resonance diagnosis. Spine (Phila Pa 1976) 1997;22:1741-1746.
- Sieper J, Rudwaleit M, Baraliakos X, et al. The Assessment of SpondyloArthritis International Society (ASAS) handbook: a guide to assess spondyloarthritis.Ann Rheum Dis 2009;68(Suppl. 2):ii1–44
- Baraliakos X, Hermann KGA, Landewe R et al. Assessment of acute spinal inflammation in patients with ankylosing spondylitis by magnetic resonance imaging (MRI): a systematic comparison between contrast enhanced T1 and short tau recovery (STIR) sequences. Ann Rheum Dis 2005;64:1141-1144.
- Maksymowych WP. The role of imaging in the diagnosis and management of axial spondyloarthritis. Nat Rev Rheumatol. 2019;15(11):657-672.
- Andersson O. Rontgenbilden vid spondylarthritis ankylopoetica. Nord Med Tidskr 1937;14:2000–2.
- Kabasakal Y, Garrett SL, Calin A. The epidemiology of spondylodiscitis in ankylosing spondylitis: a controlled study. Br J Rheumatol 1996;35:660–3.
- Waheed G, Soliman MAR, Ali AM, Aly MH. Spontaneous spondylodiscitis: review, incidence, management, and clinical outcome in 44 patients. Neurosurg Focus. 2019, 1;46(1):E10.
- Li C, Zuo Y, Wu N, et al. Synovitis, acne, pustulosis, hyperostosis and osteitis syndrome: a single centre study of a cohort of 164 patients. Rheumatology (Oxford). 2016;55(6):1023-1030.
- Govoni M, Colina M, Massara A, Trotta F. “SAPHO syndrome and infections”. Autoimmun Rev. 2009;8(3):256-9.
- Leone A, Cassar-Pullicino VN, Casale R, Magarelli N, Semprini A, Colosimo C. The SAPHO syndrome revisited with an emphasis on spinal manifestations. Skeletal Radiol. 2015;44(1):9-24.
- Colina M, Govoni M, Orzincolo C, Trotta F. Clinical and radiologic evolution of synovitis, acne, pustulosis, hyperostosis, and osteitis syndrome: a single center study of a cohort of 71 subjects. Arthritis Rheum. 2009,15;61(6):813- 21.
- Earwaker JWS, Cotten A. SAPHO: syndrome or concept? Imaging findings. Skelet Radiol. 2003;32:311–27.
- Bennet AN, Rehman A, Hensor EM, Marzo-Ortega H, Emery P, McGonagle D. The fatty Romanus lesion: a non-inflammatory spinal MRI lesion specific for axial spondyloarthropathy. Ann Rheum Dis. 2010;69(5):891–4.
- Laredo JD, Vuillemin-Bodaghi V, Boutry N, CottonA, Parlier-Cuau C. SAPHO syndrome: MR appearance of vertebral involvement. Radiology. 2007;242(3):825–31.
- Nachtigal A, Cardinal E, Bureau NJ, Sainte-Marie LG, Milette F. Vertebral involvement in SAPHO syndrome: MRI findings. Skelet Radiol. 1999;28:163–8.
- Anderson SE, Heini P, Sauvain MJ. Imaging of chronic recurrent multifocal osteomyelitis of childhood first presenting with isolated primary spinal involvement. Skelet Radiol. 2003;32(6):328–36.
- Depasquale R, Kumer N, Lalam RK, et al. SAPHO: what radiologists should know. Clin Radiol. 2012;67:195–206.
- Modic MT, Masaryk TJ, Ross JS, et al. Imaging of degenerative disk disease. Radiology 1988;168:177–86.
- Albert HB, Sorensen JS, Christensen BS, et al. Antibiotic treatment in patients with chronic low back pain and vertebral bone edema (Modic type 1 changes): a double-blind randomized clinical controlled trial of efficacy. Eur Spine J 2013;22:697–707.
- Donmez H, Mavili E, Ikizceli T, Koc RK. Pediatric intervertebral disc calcification. Diag Int Radiol (Ankara, Turkey). 2008;14(4): 225–7.
- Spapens N,Wouters C,Moens P. Thoracolumbar intervertebral disc calcifications in an 8-year-old boy: case report and review of the literature. Eur J Pediatr. 2010;169(5):577–80.
- Salaffi F, Carotti M, Di Carlo M, Sessa F, Malavolta N, Polonara G, Giovagnoni A. Craniocervical junction involvement in musculoskeletal diseases: an area of close collaboration between rheumatologists and radiologists. Radiol Med. 2020;125(7):654-667.
- Bangert BA,ModicMT, Ross JS,ObuchowskiNA, Perl J, Ruggieri PM, et al. Hyperintense disks on T1-weighted MR images: correlation with calcification. Radiology. 1995;195(2):437–43.
- Nogueira-Barbosa MH, da Silva Herrero CF, PasqualiniW, Defino HL. Calcific discitis in an adult patient with intravertebral migration and spontaneous remission. Skeletal Radiol. 2013;42(8):1161–4.
- Toprover M, Krasnokutsky S, Pillinger MH. Gout in the Spine: Imaging, Diagnosis, and Outcomes. Curr Rheumatol Rep. 2015;17(12):70.
- Zhou S, Xiao Y, Liu X, Zhong Y, Yang H. Gout involved the cervical disc and adjacent vertebral endplates misdiagnosed infectious spondylodiscitis on imaging: case report and literature review. BMC Musculoskelet Disord. 2019;20(1):425.
- Dharmadhikari R, Dildey P, Hide IG. A rare cause of spinal cord compression: imaging appearances of gout of the cervical spine. Skelet Radiol. 2006;35(12):942–945.
- Carotti M, Salaffi F, Ciapetti A. Computed tomography in tophaceous gout. J Rheumatol. 2010;37(6):1267-1268.
- Carotti M, Salaffi F, Piccinni P, Giovagnoni A. Ruolo della tomografia computerizzata a doppia energia nelle malattie muscoloscheletriche. https://www.rheumalab.it/site/).
- Carotti M, Salaffi F, Filippucci E, Aringhieri G, Bruno F, Giovine S, Gentili F, Floridi C, Borgheresi A, De Filippo M, Masciocchi C, Barile A, Giovagnoni A. Clinical utility of Dual Energy Computed Tomography in gout: current concepts and applications. Acta Biomed. 2020,13;91(8- S):116-124.
- Ogdie A, Taylor WJ, Weatherall M, et al. Imaging modalities for the classification of gout: Systematic literature review and meta-analysis. Ann Rheum Dis. 2015;74:1868–1874.
- Neogi T, Jansen TL, Dalbeth N, Fransen J, Schumacher HR, Berendsen D, Brown M, Choi H, Edwards NL, Janssens HJ, Lioté F, Naden RP, Nuki G, Ogdie A, Perez-Ruiz F, Saag K, Singh JA, Sundy JS, Tausche AK, Vaquez-Mellado J, Yarows SA, Taylor WJ. 2015 Gout classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative. Ann Rheum Dis. 2015;74(10):1789-1798.
- Yen PS, Lin JF, Chen S Y, Lin SZ. Tophaceous gout of the lumbar spine mimicking infectious spondylodiscitis and epidural abscess: MR imaging findings. J Clin Neurosci. 2005;12(1):44-46.
- Khalfallah M, Faure A, Hamel O, et al. La spondylarthropathie érosive du dialysé rénal. A propos d’un cas, revue de la littérature [Dialysis-associated spondyloarthropathy. Case report and literature review]. Neurochirurgie. 2005;51(3-4 Pt 1):165-172.
- Maruyama H, Gejyo F, Arakawa M. Clinical studies of destructive spondyloarthropathy in long-term hemodialysis patients. Nephron 1992; 61:37–44.
- Pak F, Lash J. Destructive spondyloarthropathy: an overview. Int J Artif Organs. 1999;22(8):531-535.
- Moriniere P, Marie A, El Esper N, et al. Destructive spondyloarthropathy in β2-microglobulin amyloid deposits in a uremic patient before chronic hemodialysis. Nephron 1991; 59:654–657.
- Karakida O, Aoki I, Kanno Y, et al. Hemodialysis-related arthropathy. A prospective MR study with SE and GRE sequences. Acta Radiologica 1997;38:158-64.
- Theodorou DJ, Theodorou SJ, Resnick D. Imaging in dialysis spondyloarthropathy. Semin Dial. 2002;15(4):290- 296. doi:10.1046/j.1525-139x.2002.00070.x.
- Tsantes AG, Papadopoulos DV, Vrioni G, Sioutis S, Sapkas G, Benzakour A, Benzakour T, Angelini A, Ruggieri P, Mavrogenis AF, World Association Against Infection In Orthopedics And Trauma W A I O T Study Group On Bone And Joint Infection Definitions. Spinal Infections: An Update. Microorganisms. 2020,27;8(4):476.
- Petkova AS, Zhelyazkov CB, Kitov BD. Spontaneous Spondylodiscitis – Epidemiology, Clinical Features, Diagnosis and Treatment. Folia Med (Plovdiv). 2017;59(3):254- 260). doi:10.1515/folmed-2017-0024)
- Yeom JA, Lee IS, Suh HB, Song YS, Song JW. Magnetic Resonance Imaging Findings of Early Spondylodiscitis: Interpretive Challenges and Atypical Findings. Korean J Radiol. 2016;17(5):565-80.
- Hsieh PC, et al. Pyogenic vertebral osteomyelitis: report of 9 cases and review of the literature. Rev Infect Dis 1979;1:754e76.
- Leal FS, de Tella OI Jr, Bonatelli Ade PL, et al. Septic spondylodiscitis: diagnosis and treatment. Arq Neuropsiquiatr 2003;61(3-B):829e35.
- Gentile L, Benazzo F, De Rosa F, et al. A systematic review: characteristics, complications and treatment of spondylodiscitis. Eur Rev Med Pharmacol Sci. 2019;23(2 Suppl):117-128.
- Murray MR, Schroeder GD, Hsu WK. Granulomatous Vertebral Osteomyelitis: An Update. J Am Acad Orthop Surg. 2015;23(9):529-538.
- DeSanto J, Ross JS. Spine infection/inflammation. Radiol Clin North Am. 2011;49(1):105-127.
- Trecarichi EM, Di Meco E, Mazzotta V, Fantoni M. Tuberculous spondylodiscitis: epidemiology, clinical features, treatment, and outcome. Eur Rev Med Pharmacol Sci. 2012;16 Suppl 2:58-72.
- Kotil K, Alan MS, Bilge T. Medical management of Pott disease in the thoracic and lumbar spine: a prospective clinical study. J Neurosurg Spine 2007;6(3):222–8.
- Gouliouris T, Aliyu SH, Brown NM. Spondylodiscitis: update on diagnosis and management. J Antimicrob Chemother. 2010;65 Suppl 3:iii11-iii24.
- Chapman M, Murray RO, Stoker DJ. Tuberculosis of the bones and joints. Semin Roentgenol 1979; 14:266e82.
- Sharif HS, Clark DC, Aabed MY, et al. MR imaging of mycetoma: comparison with CT. Radiology 1991; 178:865e70.
- Bell D, Cockshot WP. Tuberculosis of the vertebral pedicles. Radiology 1971;99:43.
- Ulu-Kilic A, Karakas A, Erdem H, Turker T, Inal AS, Ak O, Turan H, Kazak E, Inan A, Duygu F, Demiraslan H, Kader C, Sener A, Dayan S, Deveci O, Tekin R, Saltoglu N, Aydın M, Horasan ES, Gul HC, Ceylan B, Kadanalı A, Karabay O, Karagoz G, Kayabas U, Turhan V, Engin D, Gulsun S, Elaldı N, Alabay S. Update on treatment options for spinal brucellosis. Clin Microbiol Infect. 2014;20:O75–O82.
- Seleem MN, Boyle SM, Sriranganathan N. Brucellosis: a re-emerging zoonosis. Vet Microbiol. 2010;140:392–398.
- Bozgeyik Z, Aglamis S, Bozdag PG, Denk A. Magnetic resonance imaging findings of musculoskeletal brucellosis. Clin Imaging. 2014;38:719–723.
- Lim KB, Kwak YG, Kim DY, Kim YS, Kim JA. Back pain secondary to Brucella spondylitis in the lumbar region. Ann Rehabil Med. 2012;36:282–286.
- Chelli Bouaziz M, Ladeb MF, Chakroun M, Chaabane S. Spinal brucellosis: a review. Skeletal Radiol. 2008;37:785– 790.
- Tuna N, Ogutlu A, Gozdas HT, Karabay O. Pedro Pons’ sign as a Brucellosis complication. Indian J Pathol Microbiol. 2011;54:183–184.
- Williams RL, Fukui MB, Meltzer CC, et al. Fungal spinal osteomyelitis in the immunocompromised patient: MR findings in three cases. AJNR Am J Neuroradiol 1999;20:381e5.
- Turunc T, Demiroglu YZ, Uncu H, Colakoglu S, Arslan H. A comparative analysis of tuberculous, brucellar and pyogenic spontaneous spondylodiscits patients. J Infect 2007;55:158-163.
- Moritani T, Kim J, Capizzano AA, et al. Pyogenic and non-pyogenic spinal infections: emphasis on diffusion-weighted imaging for the detection of abscesses and pus collections. Br J Radiol 2014;87:20140011.
- Calvo JM, Ramos JL, Garcia F, Bureo JC, Bureo P, Perez M. [Pyogenic and non-pyogenic vertebral osteomyelitis: descriptive and comparative study of a series of 40 cases] Enferm Infect Microbiol Clin. 2000;18:452-456.
- Miller DJ, Mejicano GC. Vertebral osteomyelitis due to Candida species: case report and literature review. Clin Infect Dis. 2001;33: 523-530.
- McLeod N, Fisher M, Lasala PR. Vertebral osteomyelitis due to Candida species. Infection. 2019;47(3):475-478.
- Hummel M, Schuler S, Weber U, Schwertlick G, Hempel S, Theiss D, Rees W, Mueller J, Hetzer R. Aspergillosis with Aspergillus osteomyelitis and diskitis after heart transplantation: surgical and medical management. J Heart Lung Transplant. 1993;12:599-603.
- Vinas FC, King PK, Diaz FG. Spinal aspergillus osteomyelitis. Clin Infect Dis. 1999;28:1223-1229.
- Liu PY. Cryptococcal osteomyelitis: case report and review. Diagn Microbiol Infect Dis.1998;30:33-35.
- McGahan JP, Graves DS, Palmer PE. Coccidioidal spondylosis; usual and unusual radiographic manifestations. Radiology 1980;136:5-9.
- Eller JL, Siebert PE. Sclerotic vertebral bodies. An unusual manifestation of disseminated coccidioidomycosis. Radiology 1969;93:1099-100.
- Dalinka CM, Greendyke CW. The spinal manifestations of coccidiomycosis. J Can Assoc Radiol 1971;22:93-9.
- Hadjipavlou AG, Mader JT, Nauta HJ, Necessary JT, Chaljub G, Adesokan A. Blastomycosis of the lumbar spine: Case report and review of the literature, with emphasis on diagnostic laboratory tools and management. Eur Spine J. 1998;7:416-421.
- Saccente M, Abernathy RS, Pappas PG, Shah HR, Bradsher RW. Vertebral blastomycosis with paravertebral abscess: report of eight cases and review of the literature. Clin Infect Dis. 1998;26:413-418.
- Leite CC, Jinkins JR, Escobar BE, et al. MR imaging of intramedullary and intraduralextramedullary spinal cysticercosis. AJR Am J Roentgenol 1997;169:1713-7.
- Shih RY, Koeller KK: Bacterial, fungal, and parasitic infections of the central nervous system: radiologic-pathologic correlation and historical perspectives. Radiographics 2015;35:1141–1169.
- Ferrari TC, Moreira PR: Neuroschistosomiasis: clinical symptoms and pathogenesis. Lancet Neurol 2011;10:853– 864.
- Silva LC, Maciel PE, Ribas JG, Souza-Pereira SR, Antunes CM, Lambertucci JR: Treatment of schistosomal myeloradiculopathy with praziquantel and corticosteroids and evaluation by magnetic resonance imaging: a longitudinal study. Clin Infect Dis 2004;39:1618–1624.
- Kung DH, Hubenthal EA, Kwan JY, Shelburne SA, Goodman JC, Kass JS: Toxoplasmosis myelopathy and myopathy in an AIDS patient: a case of immune reconstitution inflammatory syndrome? Neurologist 2011;17:49–51.
- García-García C, Castillo-Álvarez F, Azcona-Gutiérrez JM, Herraiz MJ, Ibarra V, Oteo JA: Spinal cord toxoplasmosis in human immunodeficiency virus infection/acquired immunodeficiency syndrome. Infect Dis (Lond) 2015;47:277–282.
- Garcia-Gubern C, Fuentes CR, Colon-Rolon L, Masvidal D: Spinal cord toxoplasmosis as an unusual presentation of AIDS: case report and review of the literature. Int J Emerg Med 2010;3:439–442.
- Arif S, Zaheer S. Intradural extramedullary primary hydatid cyst of the spine in a child: a very rare presentation. Eur Spine J. 2009;18(Suppl 2):179–182.
- Lakhdar F, Arkha Y, Rifi L, Derraz S, Ouahabi A, Khamlichi A. Spinal intradural extramedullary hydatidosis: report of three cases. Neurosurgery. 2009;65:372–377.
- Lotfinia I, Sayyahmelli S, Mahdkhah A, Shoja MM. Intradural extramedullary primary hydatid cyst of the spine: a case report and review of literature. Eur Spine J. 2013;22 Suppl 3(Suppl 3):S329-S336.
- Braithwaite P, Lees R. Vertebral hydatid disease: radiological assessment. Radiology. 1981;140:763–766.
- Berk C, Erdogan A. MRI in primary intraspinal extradural hydatid disease: case report. Neuroradiology. 1998;40:390– 392.
