LA CAPILLAROSCOPIA NELLA SCLEROSI SISTEMICA
AUTORI:
Rossella De Angelis1, Erica Moscioni1, Francesca Francioso1
1Clinica Reumatologica-Dipartimento di Scienze Cliniche e Molecolari – Università Politecnica delle Marche,
Cenni storici, tecnica e indicazioni
La capillaroscopia è una metodica d’indagine non invasiva che consente la valutazione “in vivo” del microcircolo, abitualmente a livello della cute periungueale. Questa tecnica trova le sue radici nel XVII secolo, quando il medico Johan Christophorus Kohlhaus usò per la prima volta un rudimentale microscopio per osservare i capillari. Successivamente, l’italiano Gio-vanni Rasori (1776–1873) fu il primo a dimostrare la stretta relazione tra l’infiammazione congiuntivale e la presenza di capillari aggrovigliati, mediante l’utilizzo di una lente d’ingrandimento. La prima descrizione dell’ischemia reversibile locale a livello di mani, piedi, naso e lingua si deve a Maurice Raynaud (1834–1881). Da allora, lo studio del microcircolo ha subito un’importante accelerazione e, nel corso del XX secolo, in particolare a partire dagli anni ’80, si è registrato un progressivo aumento degli studi e delle ricerche sull’argomento, soprattutto grazie al perfezionamento delle tecniche e dei dispositivi diagnostici (1, 2). Al giorno d’oggi, sono molteplici gli strumenti che possono essere utilizzati per l’indagine capillaroscopica: oftalmoscopio, dermatoscopio, microscopio ottico, stereomicroscopio, videocapillaroscopio. Quest’ultimo è attualmente lo strumento più adoperato e combina una sonda ottica con una videocamera digitale, permettendo l’acquisizione di immagini ad alta risoluzione (che vengono riportate su un monitor) e la valutazione agevole del microcircolo anche a livello della cute non periungueale. L‘ingrandimento utilizzato solitamente è pari a 200x, con un range che può variare da 50x a 500x (1,3). La capillaroscopia è generalmente effettuata a livello periungueale poiché in tale distretto i capillari decorrono parallelamente al piano di osservazione (1,4). L’esame capillaroscopico va eseguito in tutte le dita, dopo l’applicazione di una goccia di olio di cedro, utile ad ottenere le migliori condizioni di visibilità dei capillari (4). La principale indicazione all’esame capillaroscopico è rappresentata dall’ inquadramento e la diagnosi differenziale del fenomeno di Raynaud (FR). E’ inoltre considerata un’indagine di primo livello per il precoce riconoscimento delle sclerosi sistemica (SSc) in fase iniziale, specie quando il fenomeno di Raynaud costituisce il sintomo di esordio, o si manifesta in forma clinicamente isolata, insieme alla positività degli autoanticorpi specifici. In presenza di una diagnosi definita di SSc, infine, la capillaroscopia, può rappresentare un valido ausilio nella prognosi di malattia, e, di recente, ha rivelato interessanti opportunità nel monitoraggio della risposta al trattamento con farmaci “vasoattivi” (2-4). In linea generale, tenendo presente l’architettura d’insieme del microcircolo periungueale, definita come vascolarizzazione cutanea di tipo “terminale” (Fig.1), i principali parametri che vanno analizzati durante l’esame capillaroscopico sono la direzione e la distribuzione spaziale delle anse, la lunghezza ed il diametro dei capillari, la densità ed il tipo di flusso all’interno dei vasi, la regolare disposizione e visibilità del plesso venoso subpapillare. Sulla base delle caratteristiche di questi parametri è possibile distinguere i quadri capillaroscopici normali da quelli patologici.
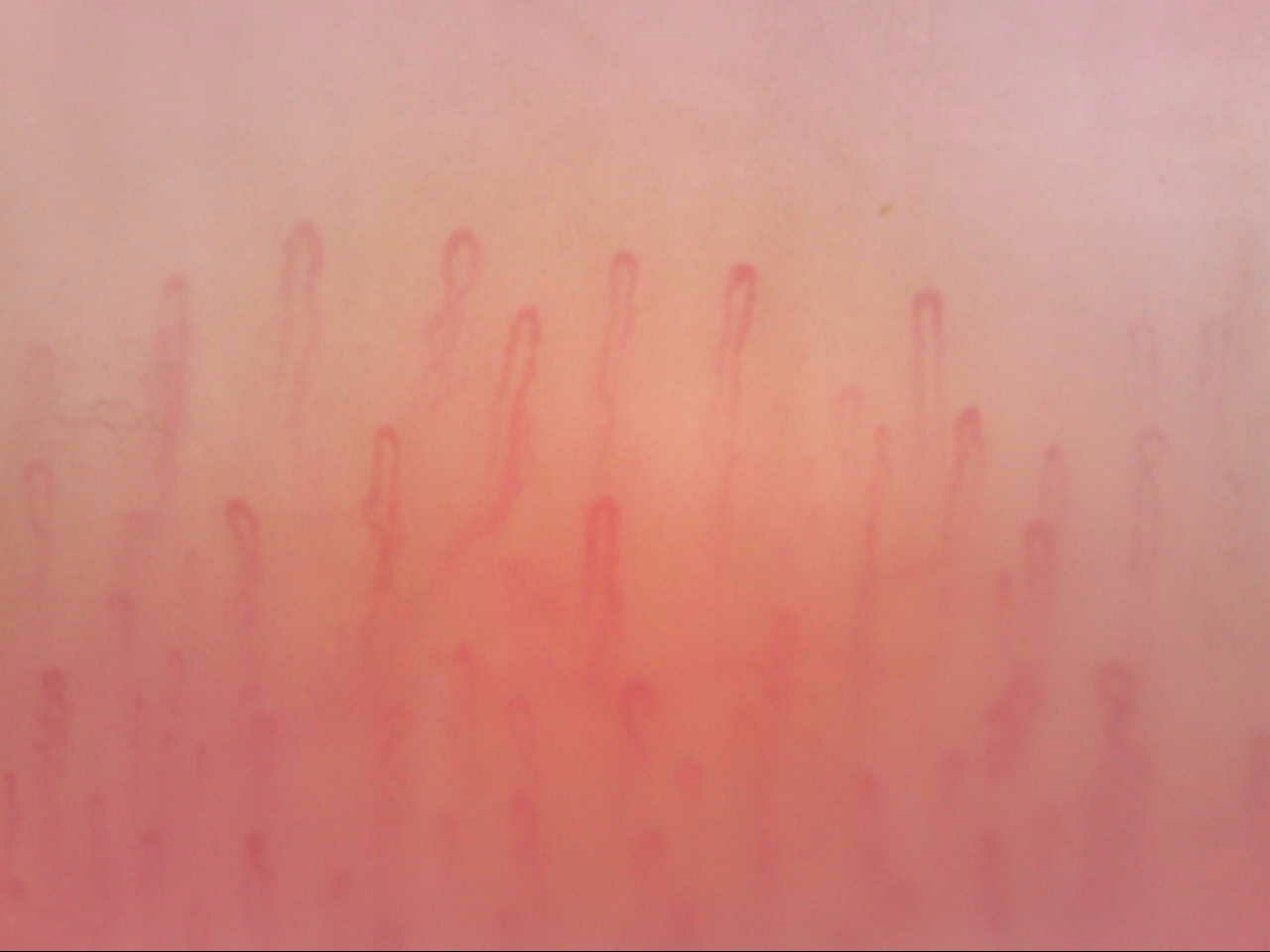
Figura 1. Videocapillaroscopia periungueale 200x. Quadro normale, con distribuzione omogenea dei capillari.
Breve descrizione del quadro capillaroscopico normale
Il quadro capillarosocopico normale si caratterizza per l’omogeneità di morfologia, orientamento e distribuzione dei capillari, che si presentano come una “U rovesciata”, disposti “a pettine”, di lunghezza lungo l’asse maggiore compresa tra 100 e 300 μm e con ampiezza variabile da 25 a 50 μm. La porzione ascendente dell’an-sa (branca afferente o arteriolare) ha un diametro compreso tra 7 e 17 μm e la porzione discendente (branca efferente o venulare) tra 11 e 20 μm (4) (Fig. 2).
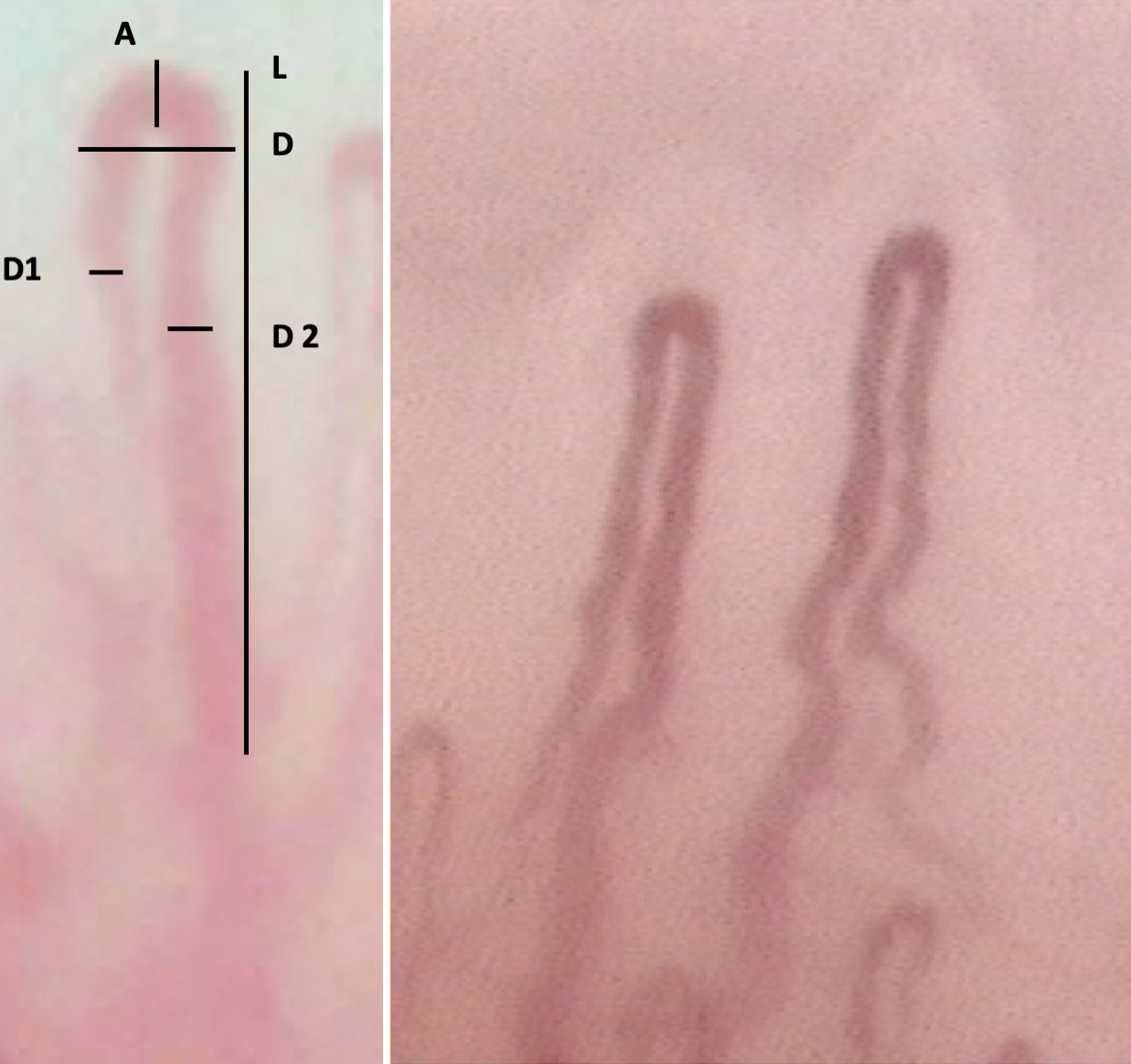
Figura 2. Misure di un’ansa capillare. L= lunghezza, D=diametro, D1= diametro arteriolare, D2= Diametro venulare, A=diametro apicale.
Il numero dei capillari varia da 9 a 13. Il plesso venoso sub-papillare è invece costituito da un intreccio di capillari nella zona di congiunzione tra lo strato reticolare e papillare del derma, perpendicolare alle anse terminali, la cui visibilità durante la capillaroscopia è condizionata dal grado di trasparenza della cute (Fig.3).
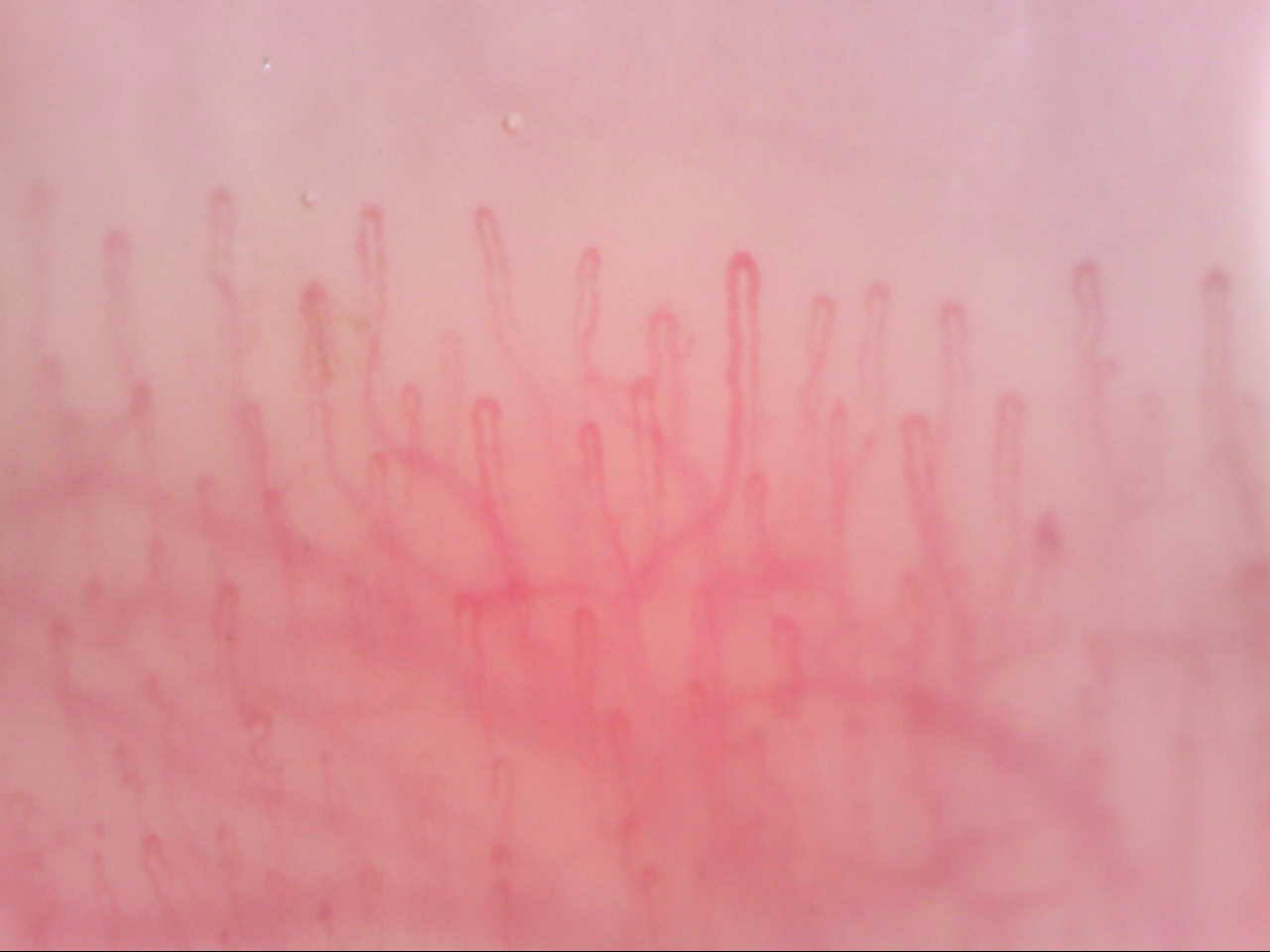
Figura 3. Videocapillaroscopia periungueale 200x. Distribuzione omogenea dei capillari. Ottima visibilità del plesso venoso sub-papillare.
La morfologia delle anse e la loro distribuzione possono risultare leggermente differenti tra soggetto e soggetto (variabilità inter-individuale) o tra le diverse dita dello stesso soggetto (variabilità intra-individuale). Tali differenze sono ascrivibili ad una molteplicità di condizioni fisiologiche e parafisiologiche, quali età, sesso, onicofagia, manicure, attività lavorativa di tipo manuale, e si distinguono per la presenza di incroci singoli o multipli, biforcazioni, intersezioni, circonvoluzioni più o meno accentuate rispetto all’asse principale e soluzioni di continuità della parete con fuoriuscita di piccole quantità di plasma ed eritrociti (microemorragie “isolate”), classificate tra le cosiddette anomalie “minori”. Un quadro patologico è invece caratterizzato da marcate alterazioni dei principali parametri capillaroscopici (anomalie “maggiori”) con significative modifiche dell’orientamento, della morfologia e della distribuzione delle anse, che contribuiscono a rendere irre-golare e disomogenea l’architettura capillare.
Elementi di semeiotica capillaroscopica
Rispetto alla conformazione classica “a forcina” i capillari periungueali possono presentare vari gradi di tortuosità. Alcune anse possono esibire incroci, intrecci, ramificazioni e inginocchiamenti rispetto all’asse principale (Fig. 4). Talvolta i capillari assumono aspetto bizzarro. I capillari tortuosi, pur senza possedere carattere di specificità, sono abitualmente riscontrati in un’ampia varietà di condizioni sia reumatologiche che non reumatologiche, che includono il fenomeno di Raynaud, l’acrocianosi, il lupus eritematoso sistemico, l’artrite reumatoide, l’artrite psoriasica, l’ipertensione arteriosa, il diabete mellito, l’acromegalia, l’ipotiroidismo. Una considerevole tortuosità delle anse periungueali può essere espressione di aumento della superficie di scambio capillare (neoangiogenesi) ed è di frequente osservazione nei pazienti con dermatomiosite ed onicopatia psoriasica (3,4).
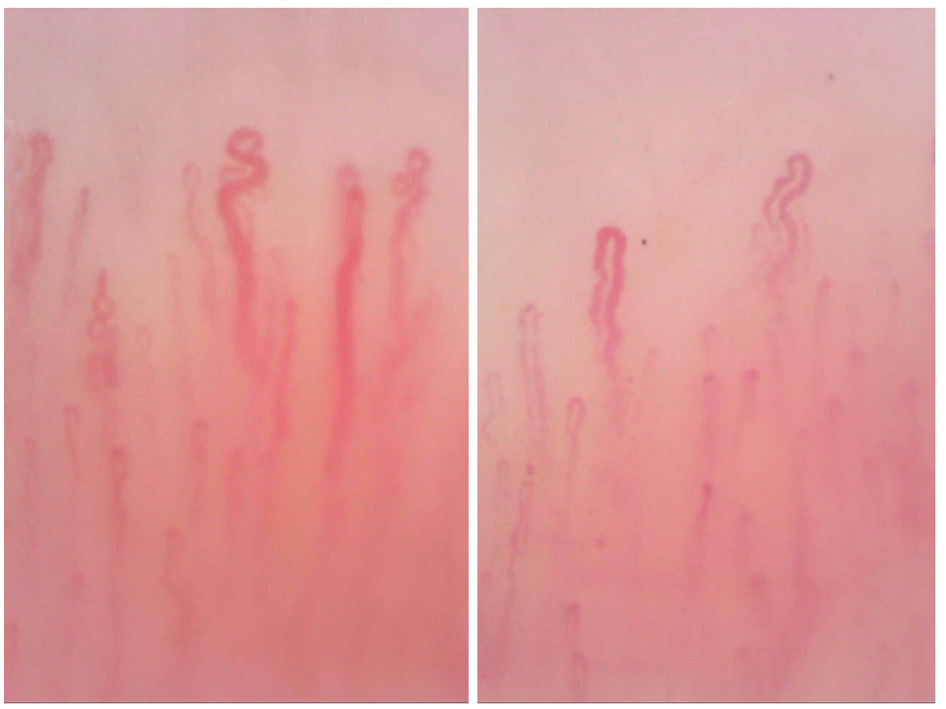
Figura 4. Videocapillaroscopia periungueale 150x. Capillari tortuosi con anomalie di decorso, dalla morfologia lievemente disomogenea. Quadro rientrante nel range di normalità.
In presenza di microangiopatia è spesso rilevabile un cospicuo aumento delle dimensioni capillari. La morfologia dei capillari ectasici è eterogenea, sia perché la dilatazione può presentarsi in maniera uniforme (ectasia regolare), sia per la possibile presenza di dilatazioni e/o restringimenti circoscritti (ectasia irregolare e/o microaneurismi). Un capillare è definito ectasico quando il suo diametro supera di 4-10 volte quello normale (4). Con il termine di “megacapillare” si designa un ansa uniformemente ectasica di diametro superiore a 50 micron (Fig. 5). I megacapillari e le ectasie irregolari sono considerate tra le anomalie morfologiche “precoci” documentabili in corso di capillaroscopia nei pazienti con SSc o con malattia riconducibile nel gruppo dei cosiddetti “scleroderma spectrum disorders-SSD” (connettivite mista, dermatomiosite, connettivite non differenziata, connettivite overlap). L’individuazione di tale anomalia è così insolita in condizioni differenti dalle sindromi sclerodermiche che nei soggetti con FR isolato il riconoscimento anche di un singolo megacapillare può rivelare una sottostante connettivite non ancora manifesta, specie se sono presenti gli anticorpi anti-centromero o gli anticorpi anti topoisomerasi-I (5-7).
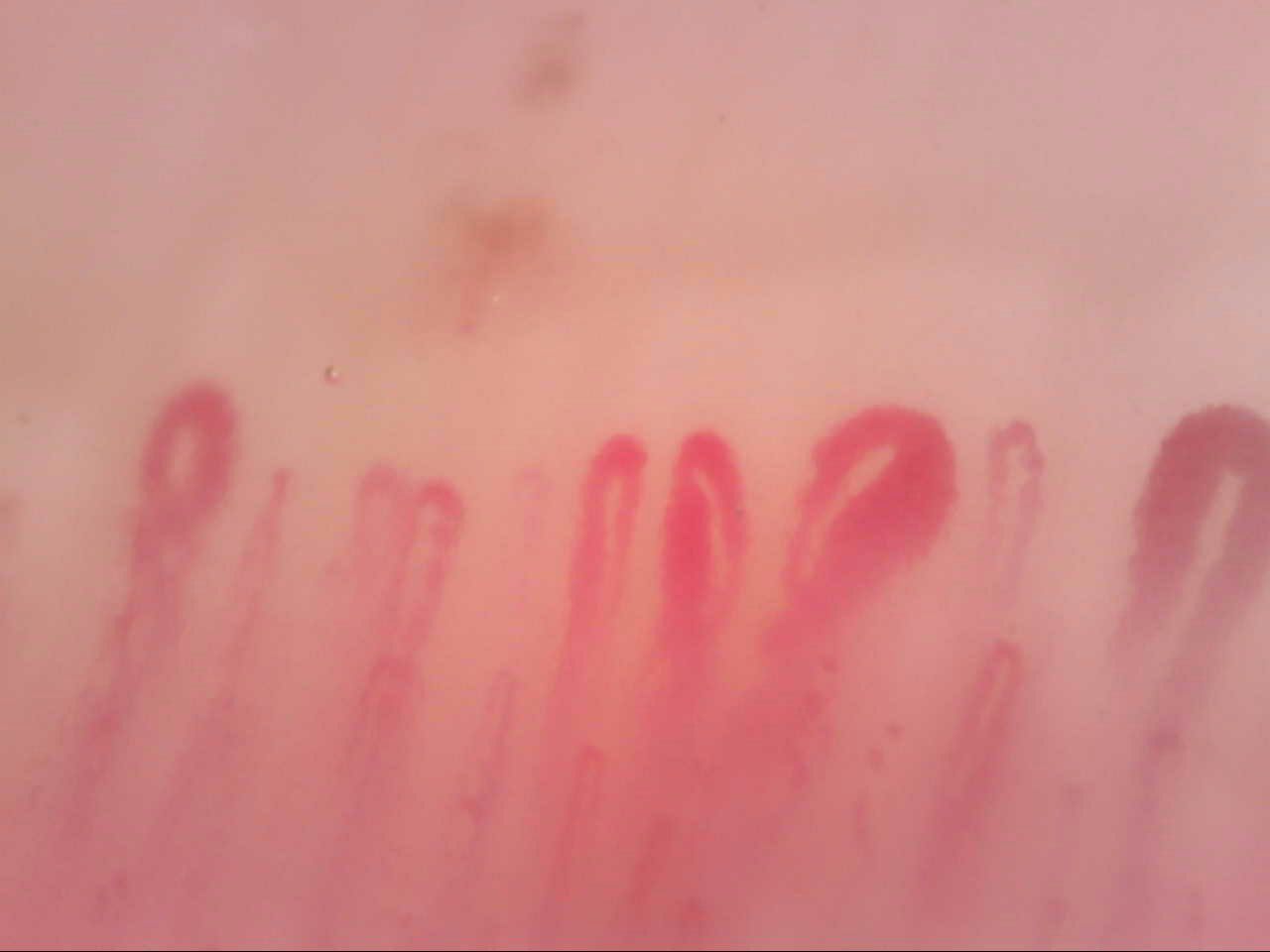
Figura 5. Videocapillaroscopia periungueale 200x. Sclerosi sistemica: capillari omogeneamente e disomogeneamente dilatati, con diametro superiore ai 100μm, al cui interno si riconosce un evidente rallentamento del flusso ematico.
Gli stravasi capillari, denominati microemorragie, costituiscono un reperto comune della microangiopatia sclerodermica e si associano con la presenza di anse dilatate, più fragili dei capillari normali (Fig. 6). Le microtrombosi si differenziano dalle microemorragie per l’evidente rallentamento del flusso e per il ristagno dei globuli rossi all’interno dell’ansa, che appare di colore rosso scuro o violaceo (Fig. 7). In determinate situazioni, le microemorragie e le microtrombosi sono presenti in cluster aggregati sul bordo periungueale, con accanto consistenti depositi di emosiderina (Fig. 8).
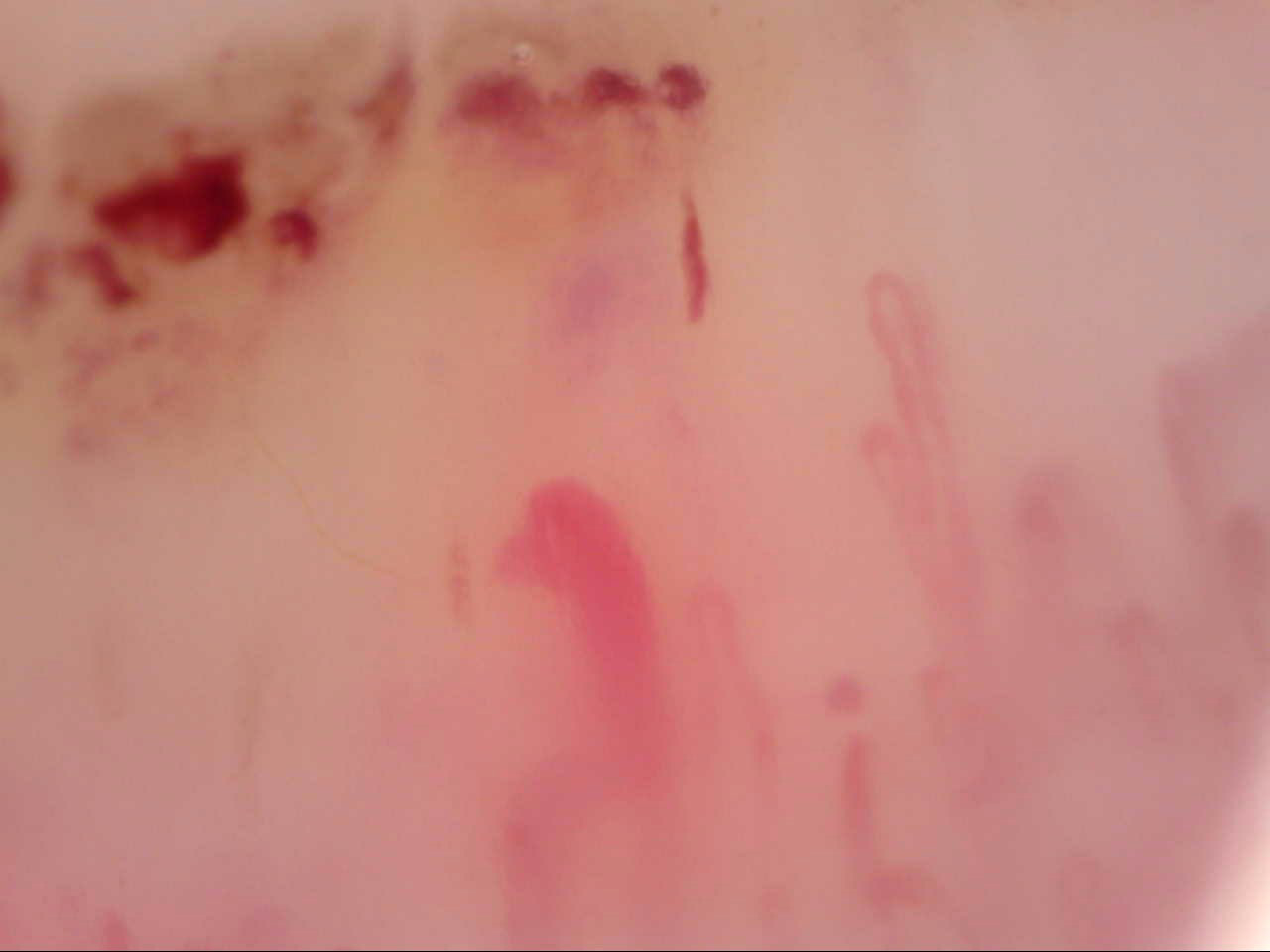
Figura 6. Videocapillaroscopia periungueale 200x. Sclerosi sistemica: multipli accumuli di emosiderina secondari a stravaso ematico.
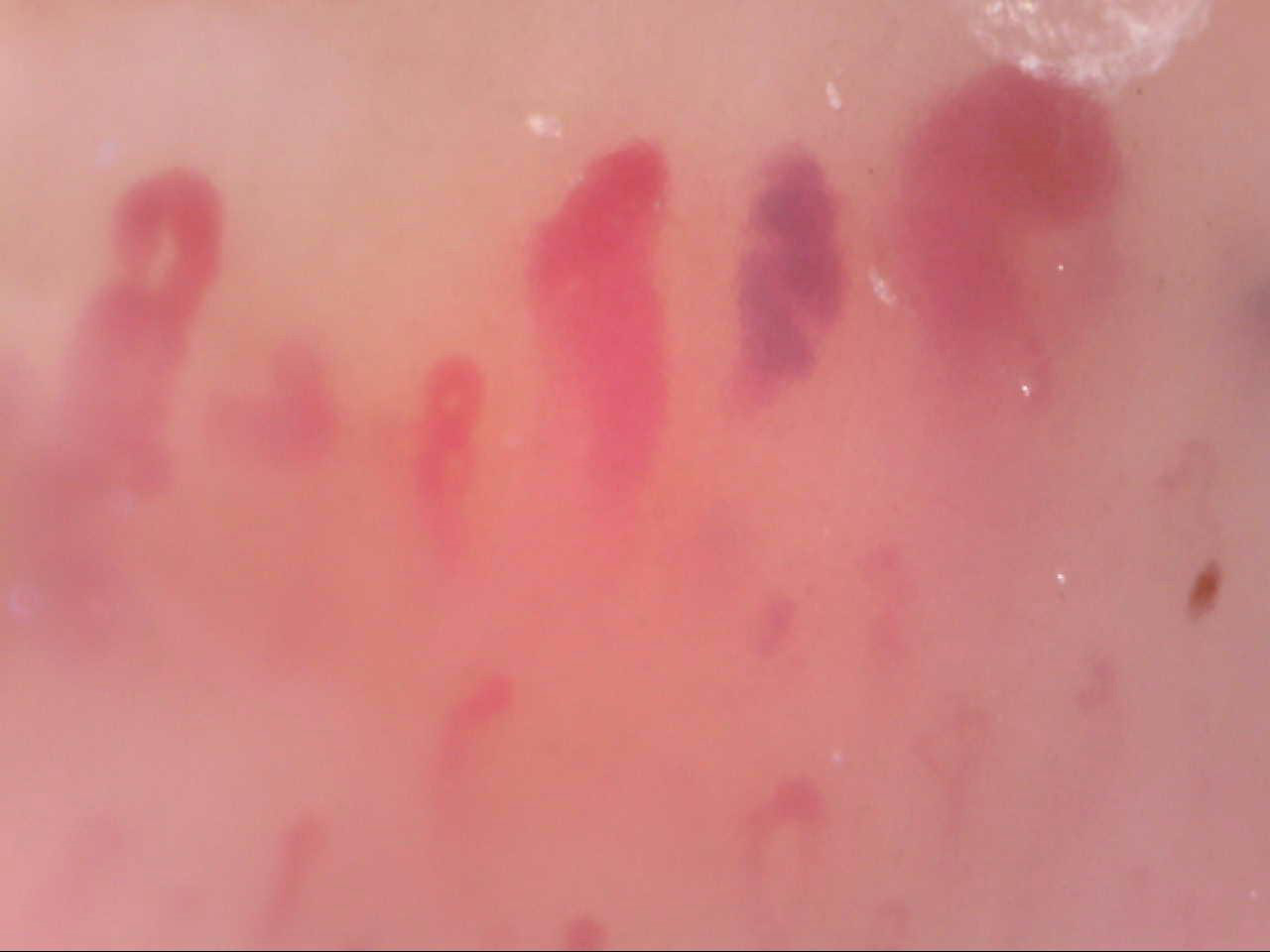
Figura 7. Videocapillaroscopia periungueale 200x. Sclerosi sistemica: trombosi capillare di colore rosso violaceo.
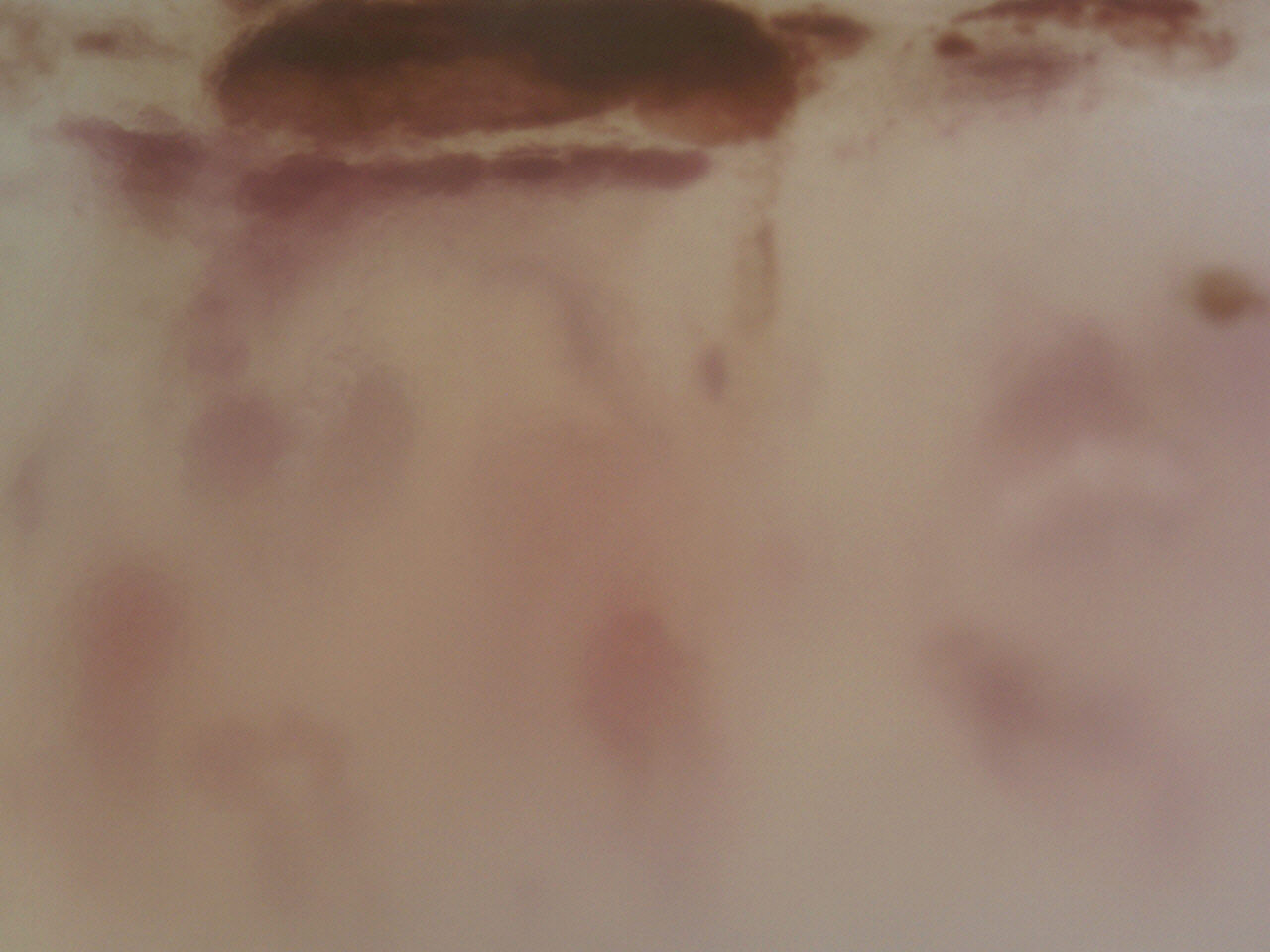
Figura 8. Videocapillaroscopia periungueale 150x. Sclerosi sistemica: abbondanti depositi di emosiderina secondari a emorragie capillari.
La neoformazione capillare si manifesta con caratteristiche morfologiche peculiari, per lo sviluppo di capillari tortuosi e ramificati, oppure allungati in maniera significativa, o ancora convoluti, avviluppati, intrecciati, o dall’ aspetto multiforme (“a cespuglio”, “a gomitolo”, “ad arbusto”). E’ un’anomalia frequente in corso di SSc e rappresenta il tentativo di compensare la riduzione globale della superficie di scambio endoteliale, per l’occlusione e la distruzione dei capillari (Fig. 9) (3,4).
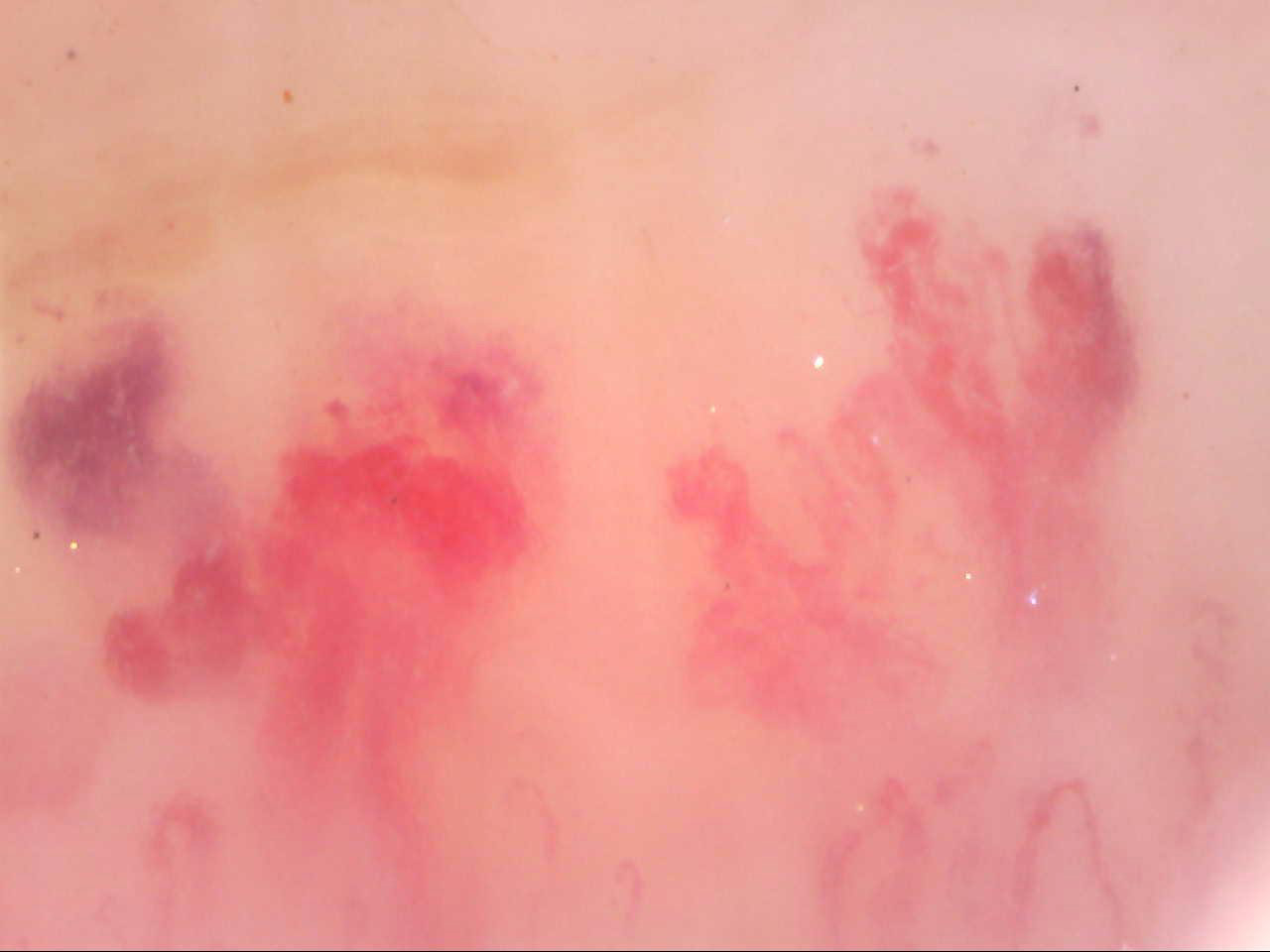
Figura 9. Videocapillaroscopia periungueale 200x. Sclerosi sistemica: sovvertimento architettonico di grado marcato con espressioni di neongiogenesi, dilatazione e fragilità della parete capillare.
La densità è determinata dalla numerosità delle anse dell’ultima fila presenti nell’unità di misura (1 mm). Una conta capillare ridotta è una delle manifestazioni più caratteristiche degli SSD e in particolari condizioni la perdita capillare può procedere incontrastata fino a determinare la comparsa di “aree avascolari” (zone sprovviste di anse per un tratto uguale o superiore a 500 micron) (Fig. 10). In corso di SSc o di malattie dello spettro sclerodermico il rilievo di aree avascolari ha un significato prognostico negativo (3,4,6,7).
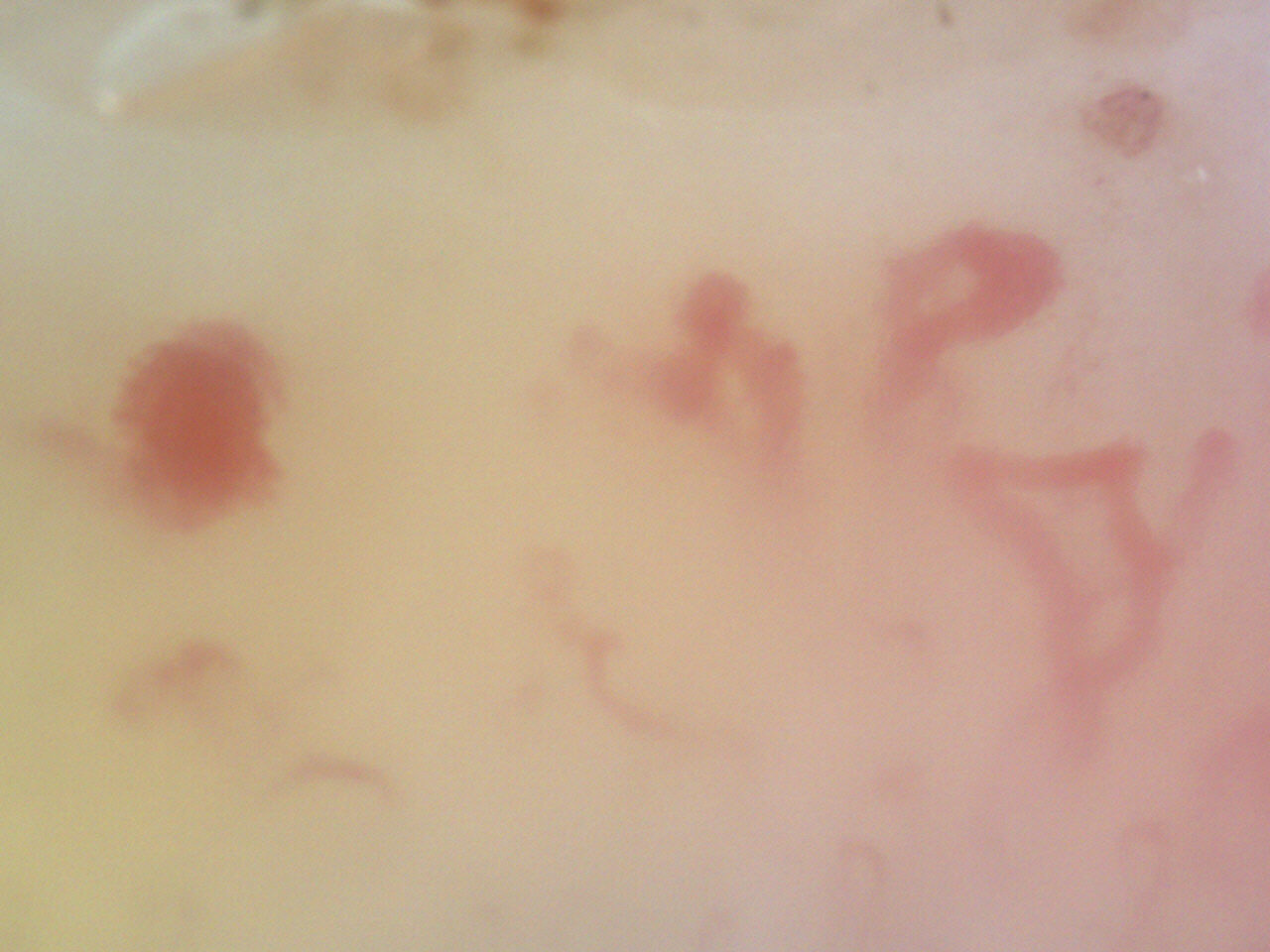
Figura 10. Videocapillaroscopia periungueale 200x. Sclerosi sistemica: scomparsa della regolare architettura capillare con aree di devascolarizzazione.
La microangiopatia sclerodermica: lo “scleroderma pattern”
Il complesso delle alterazioni del microcircolo periungueale caratteristico della SSc e delle connettiviti dello spettro sclerodermico è denominato “scleroderma pattern”. Le alterazioni salienti, o “maggiori”, sono riconoscibili per la presenza di capillari sensibilmente dilatati (megacapillari, anse giganti, ectasie irregolari, microaneurismi) (Fig. 11), di microemorragie multiple, di neoangiogenesi proteiforme, di riduzione della densità capillare fino alla comparsa di aree avascolari (Fig. 12). In questo contesto è frequente rilevare una diminuzione della visibilità, con le anse che tendono ad apparire sfocate (“effetto nebbia”) per l’edema interstiziale secondario alla fuoriuscita di plasma dai capillari danneggiati (Fig. 13). Il disordine architettonico è costante e le caratteristiche variano in relazione allo stadio evolutivo delle lesioni. Le forme cosiddette a lenta trasformazione (bradievolutive) sono costituite in prevalenza da anse ectasiche distribuite in maniera disomogenea (Fig. 14), mentre nelle forme più aggressive le aree avascolari e la neoformazione capillare contribuiscono a creare una marcata disorganizzazione dell’architettura microvasale periungueale (Fig. 15, Fig. 16).
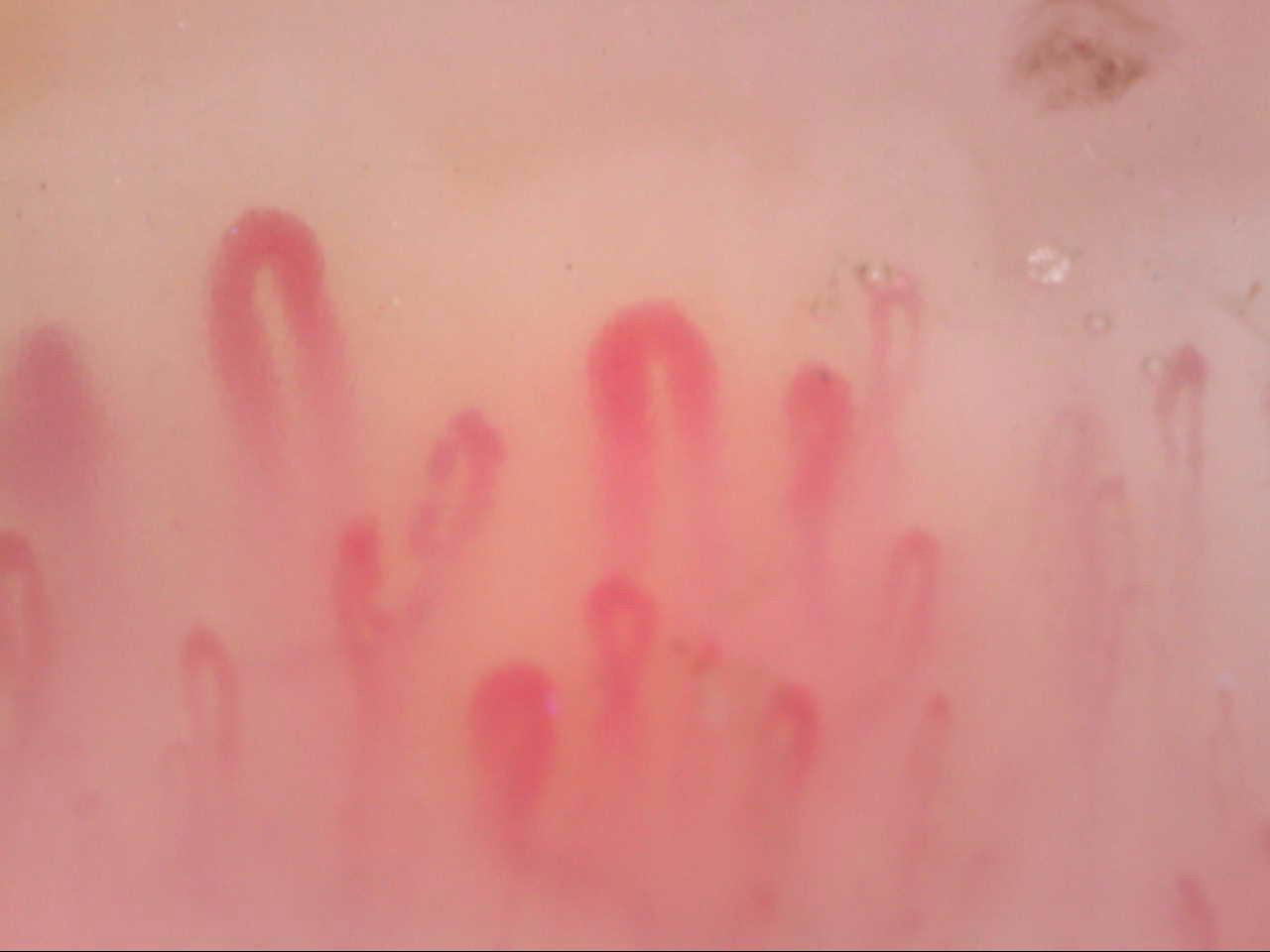
Figura 11. Videocapillaroscopia periungueale 200x. Sclerosi sistemica. Anomalie caratterizzanti lo scleroderma pattern: megacapillari.
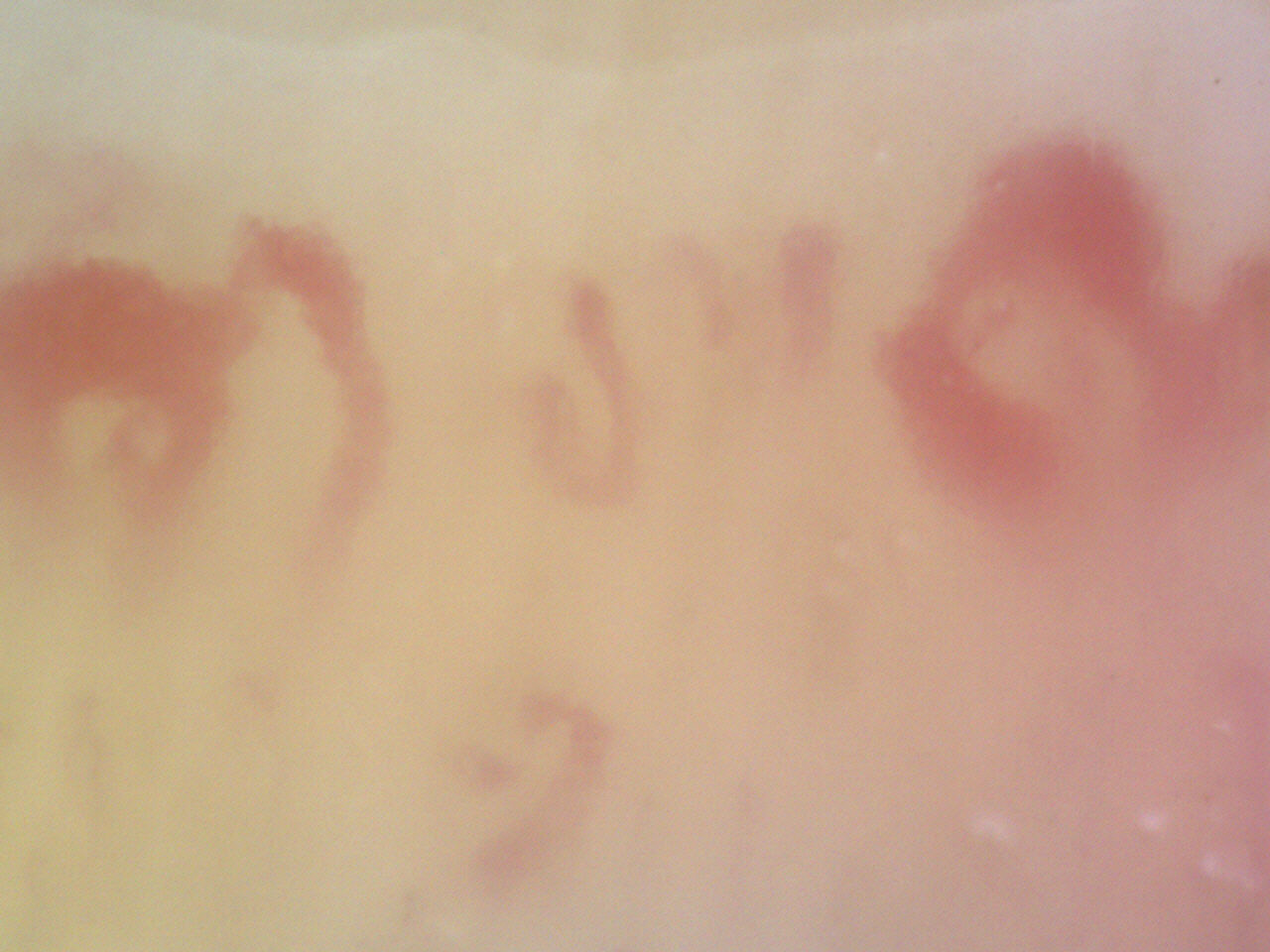
Figura 12. Videocapillaroscopia periungueale 200x. Sclerosi sistemica: capillari marcatamente ectasici e disomogenei (anse giganti), ridotta densità capillare
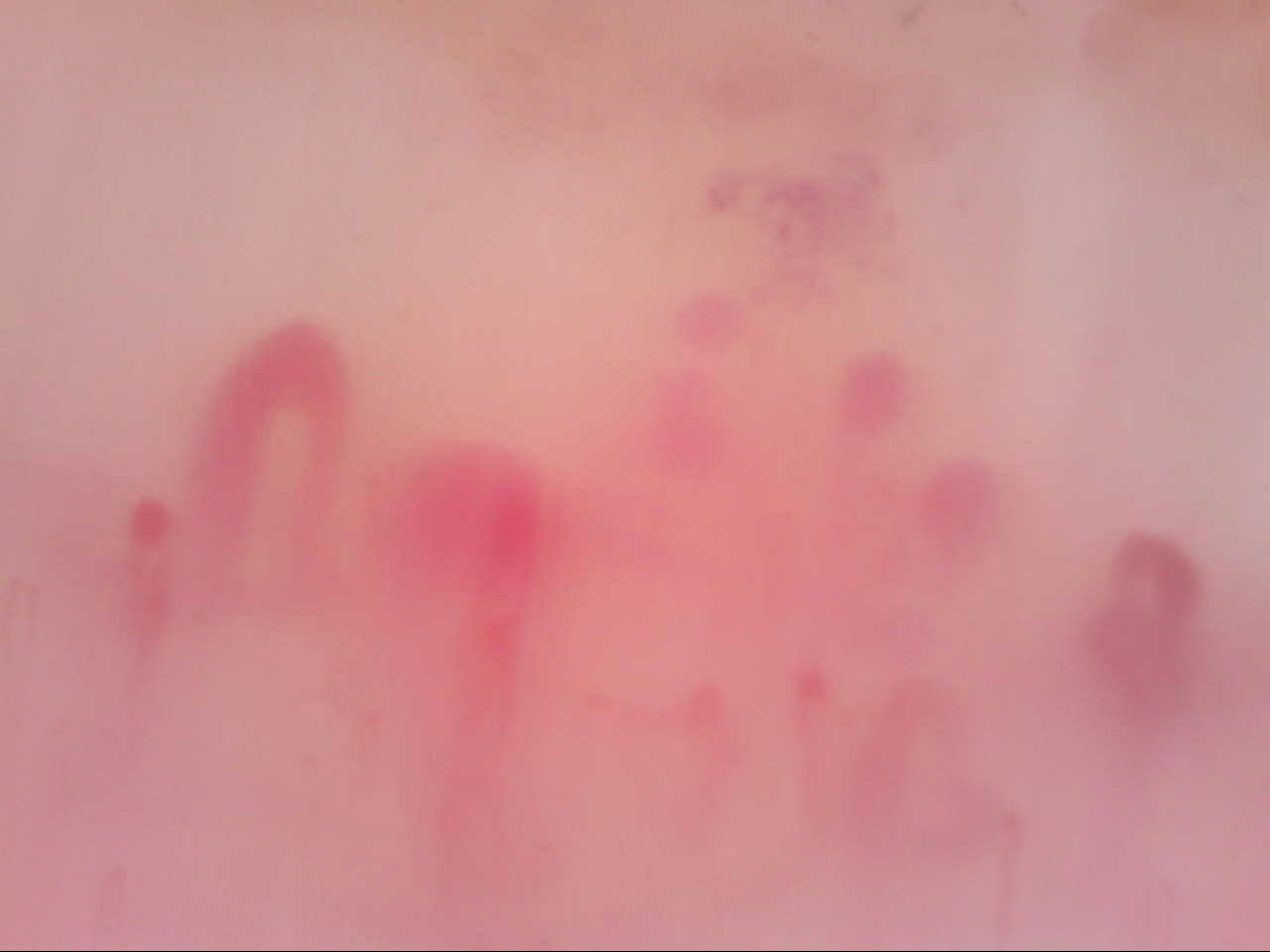
Figura 13. Videocapillaroscopia periungueale 200x. Sclerosi sistemica: megacapillari ed edema interstiziale.
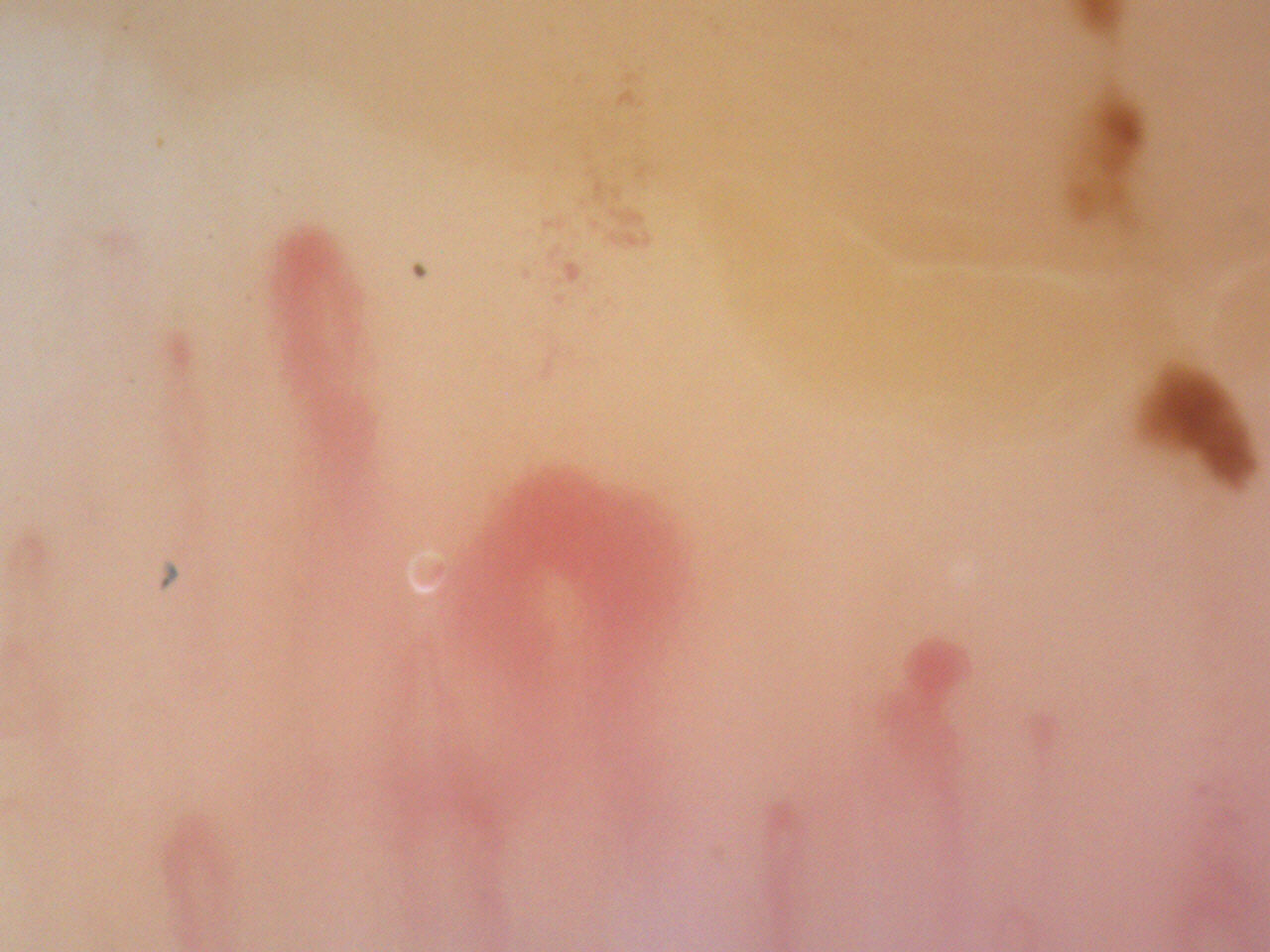
Figura 14. Videocapillaroscopia periungueale 200x. Sclerosi sistemica: scleroderma pattern “early”.
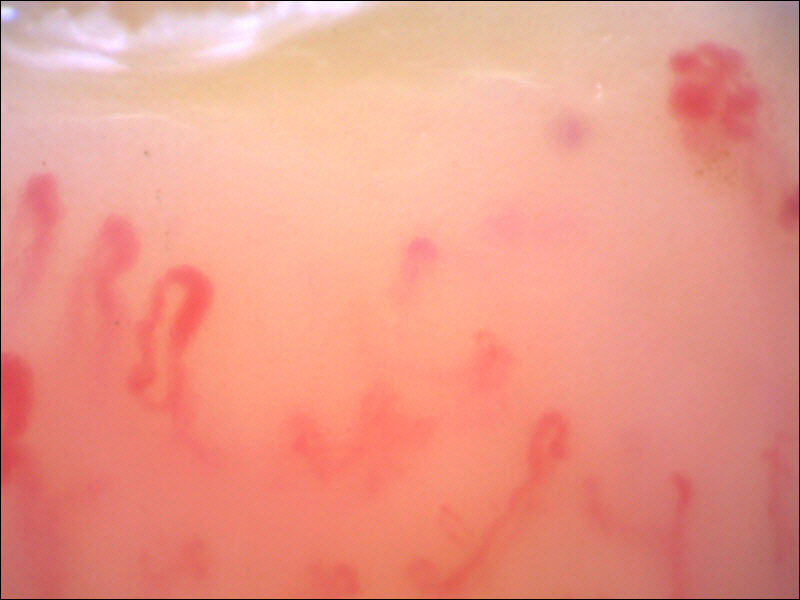
Figura 15. Videocapillaroscopia periungueale 200x. Sclerosi sistemica: marcato sovvertimento architettonico con scomparsa della regolare distribuzione capillare e tentativo di neongiogenesi.
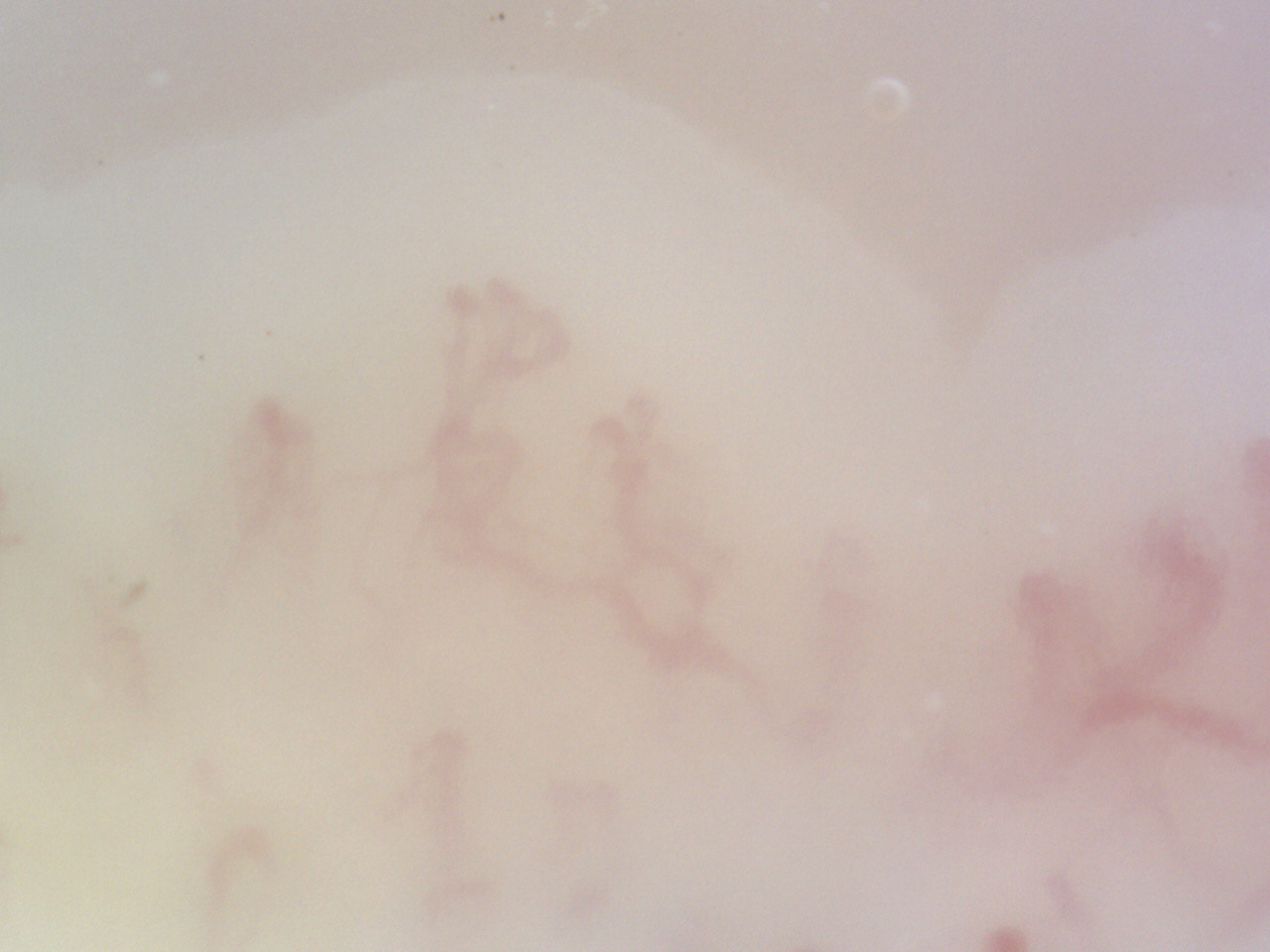
Fig. 16. Videocapillaroscopia periungueale 200x. Sclerosi siste-mica: pattern “late”.
Lo scleroderma pattern può essere osservato nel 90% dei pazienti con SSc, nel 70% circa dei pazienti con dermatomiosite, in oltre il 50% dei pazienti con connettivite mista, ed, in minor misura, nei pazienti con sindrome di Sjögren e connettivite non differenziata.
CLASSIFICAZIONE DELLO “SCLERODERMA PATTERN”
Nel 1973 Hildegard Maricq e collaboratori fu-rono i primi a definire in maniera sistematica le anomalie capillaroscopiche risultanti dall’osservazione della zona periungueale con tecniche di macrofoto-grafia nelle connettiviti dello “scleroderma spectrum”. In particolare, nei pazienti con SSc, la classificazione proposta distingueva due pattern capillaroscopici sulla base di criteri qualitativi: un pattern “slow” ed uno “active”. Il primo, caratterizzato dall’alternarsi di capillari normali con capillari ectasici, tortuosi e disomogenei e soprattutto dalla presenza di megacapillari, si associa tipicamente con una malattia poco evolutiva. Il pattern “active”, al contrario, è ritenuto solitamente espressione di una progressione rapida della malattia con prognosi peggiore, ed è caratterizzato dalla presenza di neoformazione capillare e aree avascolari (5). Questa classificazione è rimasta in voga fino all’inizio degli anni Duemila, quando Cutolo e collaboratori hanno suddiviso le alterazioni capillaroscopiche tipiche della SSc in tre gruppi distinti, anche nel tentativo di fornire una descrizione della progressione temporale del danno: un pattern “early” o iniziale, caratterizzato da un numero limitato di megacapillari, rare microemorragie, disordine architettonico assente o lieve, densità capillare conservata; un pattern “active” o attivo, caratterizzato da un numero considerevole di megacapillari e microemorragie, alcuni capillari ramificati, una modesta riduzione del numero di capillari ed un maggiore disordine architettonico; ed un pattern “late” o avanzato, in cui si evidenzia una totale disorganizzazione della normale architettura capillare, con frequenti capillari neoformati, estese aree avascolari, con megacapillari o microemorragie pressoché assenti (6-8).
Le anomalie capillaroscopiche dello scleroderma pattern possono essere valutate singolarmente in maniera qualitativa/descrittiva, discriminando la semplice presenza/assenza di alterazioni specifiche riconducibili nel contesto di uno “scleroderma pattern” oppure secondo una scala semi-quantitativa, con l’assegnazione di un punteggio ad ogni singolo parametro (0 = nessuna alterazione, 1 = ≤ 33% di alterazioni/riduzione della densità 2 = 33–66% di alterazioni/riduzione della densità, 3 = ≥ 66% di alterazioni/riduzione della densità per campo capillaroscopico unitario) per ottenere uno score complessivo. Alcuni parametri, invece, possono essere quantificati in maniera standardizzata nella loro totalità, ad esempio la densità capillare o le dimensioni capillari, per acquisire una misurazione quantitativa da ripetere nel tempo a scopo prognostico o per fini di ricerca (4).
La capillaroscopia nella diagnosi e nella prognosi della sclerosi sistemica
La SSc è una malattia eterogenea con una patogenesi basata su tre elementi: alterazione del microcircolo, produzione di autoanticorpi e disfunzione dei fibroblasti che conduce ad un deposito eccessivo di matrice extracellulare. Le manifestazioni cliniche e la prognosi della SSc sono variabili. Sulla base del coinvolgimento cutaneo, si possono distinguere tre sottogruppi principali: SSc cutanea limitata (lcSSc), SSc cutanea diffusa (dcSSc) e SSc senza coinvolgimento cutaneo.
Gli attuali criteri classificativi ACR/EULAR per la SSc sono stati definiti nel 2013 e consistono in una revisione dei criteri del 1980 dell’American Rheumatology Association (ARA) (9). I passati criteri non tenevano conto dei pazienti affetti da forme iniziali di SSc o dalla variante cutanea limitata della malattia. Nei criteri attuali rientrano l’ispessimento cutaneo delle dita, le ulcere acrali e le cicatrici digitali, le teleangectasie, l’ipertensione arteriosa polmonare e/o la malattia polmonare interstiziale, il fenomeno di Raynaud, la presenza di autoanticorpi specifici (anti-Scl-70, anti-RNA polimerasi III, anti-centromero) (9). Rispetto ai criteri risalenti al 1980 la capillaroscopia è stata riconosciuta come elemento fondamentale per la diagnosi e per tal motivo inserita nei nuovi criteri classificativi, che risultano cosi superiori per sensibilità e specificità.
Formulare una diagnosi precoce di SSc è di fondamentale importanza, ma può essere impegnativo quando la maggior parte dei segni e sintomi è assente. Le manifestazioni cliniche più precoci che inducono a sospettare una SSc sono il FR e l’edema indurativo delle dita (puffy fingers) (10). Sfortunatamente, essendo segni molto aspecifici, hanno una bassa capacità diagnostica. Di conseguenza, risulta difficile prevenire l’evoluzione della malattia, il coinvolgimento degli organi interni ed il peggioramento della qualità della vita, con aumento significativo dei costi diretti ed indiretti (11). Studi di popolazione hanno infatti dimostrato che la prevalenza della SSc è maggiore di quanto ritenuto in passato e che il coinvolgimento degli organi interni è spesso precoce, subclinico ma pronosticabile (12, 13).
Nel 2011 l’EUSTAR Group ha proposto i criteri preliminari per la “very early diagnosis of SSc” (VEDOSS), definendo la triade FR/puffy fingers/positività degli ANA come “campanelli d’allarme” per il sospetto di una SSc e la presenza dello scleroderma pattern e degli anticorpi specifici per la SSc come requisiti necessari per confermarne il sospetto (14). E’ importante sottolineare dunque che la capillaroscopia con l’identificazione del classico scleroderma pattern rientra a pieno titolo tra i criteri “necessari” per la diagnosi delle forme precocissime di malattia. Allo scopo di meglio definire i fattori predittivi di progressione verso una SSc definita, è nato il progetto VEDOSS, uno studio multicentrico condotto da 33 centri EUSTAR (10, 14, 15). I risultati preliminari scaturiti dall’analisi dei pazienti con FR arruolati nel database online confermano l’importanza dei “campanelli d’allarme” identificati dall’EUSTAR ed in particolare, lo studio riguardante le caratteristiche capillaroscopiche in grado di prevedere la progressione verso una SSc definita ha documentato (dopo un follow-up medio di 31 mesi su 66 pazienti VEDOSS) lo sviluppo di una SSc definita nel 32% dei casi. I pazienti con un’evoluzione molto rapida della malattia mostravano un diametro dell’ansa e un’ampiezza dell’apice significativamente maggiore rispetto a tutti gli altri soggetti. Ogni aumento unitario del diametro dell’apice dei capillari è associato con un aumento del rischio pari all’1%; il valore soglia di 103 μm ha dimostrato un valore predittivo positivo del 56% e negativo del 71% (15).
In soggetti con fenomeno di Raynaud isolato, la presenza di anomalie capillaroscopiche specifiche (megacapillari, microemorragie, numero di capillari nell’unità di misura) associate con la positività degli anticorpi antinucleo “specifici” (anticentromero o antitopoisomerasi I) rende possibile la messa a punto di un modello predittivo in grado di riconoscere i soggetti che svilupperanno una sclerosi sistemica (16, 17).
E’ ormai acclarato che lo sviluppo di una danno capillare riveste un ruolo fondamentale nella fisiopatologia della SSc definita ed è responsabile della comparsa di numerose manifestazioni cliniche, tra cui le ulcere digitali (DU) ed il coinvolgimento degli organi interni. Diversi studi prospettici hanno individuato nel pattern “late” un fattore predittivo indipendente per la comparsa di DU, mentre il numero di capillari/mm o, similarmente, il numero di capillari totali dell’ultima fila rappresentano un importante fattore di rischio (18, 19, 20). Una significativa associazione tra la presenza di aree avascolari con la gravità dell’impegno cutaneo, cardiaco e polmonare è stata ampiamente confermata (19, 21, 22).
Nei pazienti affetti da SSc ed ipertensione arteriosa polmonare (PAH) la stima della densità capillare può consentire il riconoscimento precoce della complicanza in circa il 20% dei casi. E’ stata inoltre dimostrata un’associazione tra la presenza di aree avascolari e l’impegno polmonare con aspetto “a vetro smerigliato” nei pazienti con SSc e storia di malattia di almeno 5 anni (21, 22).
La densità capillare risulta anche la caratteristica principale nella formulazione di score capillaroscopici nella SSc, come lo CSURI (Capillaroscopic Skin Ulcer Risk Index, utile nel prevedere la comparsa di nuove ulcere digitali) e il MES (Microangiopathy Evolution Score, indicativo della progressione del danno vascolare) (20, 23). La conta capillare a livello periungueale si è inoltre rivelata il parametro capillaroscopico maggiormente attendibile nel valutare la risposta alla terapia.
La capillaroscopia nel monitoraggio della terapia
Lo studio delle modifiche del pattern capillaroscopico in seguito alla somministrazione delle terapie utilizzate nel trattamento della SSc ha permesso di valutare l’efficacia di alcuni farmaci nel rallentare la progressione del danno microangiopatico determinato dalla malattia. In particolare le evidenze attualmente disponibili hanno registrato un miglioramento del quadro capillaroscopico in seguito alla terapia d’associazione con iloprost e bosentan (che appare maggiormente efficace rispetto all’iloprost in monoterapia), al trattamento immunosoppressivo con ciclofosfamide, rituximab e al trapianto autologo con cellule staminali ematopoietiche (23-27).
Da ultimo, un’eventuale “normalizzazione” del pattern capillaroscopico, con o senza terapia, sembra rivestire una significato prognostico favorevole (2, 4).
Punti chiave
- La capillaroscopia periungueale può essere effettuata con dispositivi ottici di vario tipo che comprendono un semplice oftalmoscopio fino a strumenti più sofisticati come il videocapillaroscopio con sonde a contatto, adatto anche per l’esplorazione della cute non periungueale.
- Le caratteristiche capillaroscopiche principali nel soggetto normale sono costituite dalla disposizione omogenea dei capillari “a pettine”, con le singole anse che assumono la forma “ad U rovesciata”, che decorrono con una branca afferente, un apice ed una branca efferente. Nella valutazione del range di normalità vanno tenute presenti la variabilità intra-individuale e quella interindividuale.
- La capillaroscopia è fondamentale per distinguere il fenomeno di Raynaud primitivo da quello secondario e ha un valore prognostico se combinata con la presenza di anticorpi antinucleari. Nei pazienti con fenomeno di Raynaud i rilievi capillaroscopici sono solitamente analizzati qualitativamente allo scopo di identificare la presenza/assenza di uno scleroderma pattern.
- Le alterazioni principali dello scleroderma pattern sono costituite da capillari marcatamente dilatati (megacapillari, anse giganti, ectasie irregolari, microaneurismi), da microemorragie multiple, da capillari neoformati dalle caratteristiche bizzarre, da riduzione della densità capillare fino alla comparsa di aree avascolari. Il disordine architettonico del microcircolo periungueale è costante e le caratteristiche variano in relazione allo stadio evolutivo delle lesioni. Le forme “a lenta trasformazione” sono composte in prevalenza da anse ectasiche, mentre nelle forme più “aggressive” sia le aree avascolari che la neoformazione capillare figurano tra le anomalie più frequenti.
- L’inclusione delle alterazioni capillaroscopiche nei criteri di classificazione della sclerosi sistemica ne ha aumentato la sensibilità e ha permesso di identificare forme precoci e incomplete della malattia.
- Le scale semiquantitative vengono generalmente adoperate per correlare il grado della microangiopatia con il coinvolgimento della cute e degli organi interni. I punteggi semiquantitivi o quantatitivi delle singole anomali capillaroscopiche vengono inseriti negli score complessivi per stratificare i soggetti con fenomeno di Raynaud “isolato” a rischio di evoluzione verso una sclerosi sistemica. Alcuni indici, infine, sono utilizzati come metodi predittivi della comparsa di ulcere digitali.
Bibliografia
- Maricq HR, LeRoy EC. Patterns of finger capillary abnormalities in connective tissue disease by “wide-field” microscopy. Arthritis Rheum 1973; 16:619-28.
-
Grassi W, De Angelis R. Capillaroscopy: questions and answers. Clin Rheumatol 2007; 26: 2009-16.
-
Grassi W, Del Medico P. Atlas of Capillaroscopy, Edra Medical Publishing & New Media, Milano, 2004.
-
De Angelis R, Sebastiani M, Manfredi A, Grassi W, Ferri C. La capillaroscopia in Reumatologia. Lesioni elementari e metodi di scoring. Collana Quaderni di Clinimetria Pratica. Mattioli 1885, Fidenza, 2012.
-
De Angelis, R., Cutolo, M., Salaffi, F., Pablo Restrepo, J., Grassi, W. Quantitative and qualitative assessment of one rheumatology trainee’s experience with a self-teaching programme in videocapillaroscopy. Clin Exp Rheumatol 2009; 27: 651-3.
-
Smith V, Herrick AL, Ingegnoli F, Damjanov N, De Angelis R, Denton CP, et al. EULAR Study Group on Microcirculation in Rheumatic Diseases and the Scleroderma Clinical Trials Consortium Group on Capillaroscopy. Standardisation of nailfold capillaroscopy for the assessment of patients with Raynaud’s phenomenon and systemic sclerosis. Autoimmun Rev 2020; 19:102458.
-
De Angelis R, Grassi W, Cutolo M. A growing need for capillaroscopy in rheumatology. Arthritis Rheum 2009; 61: 405-10.
-
Cutolo M, Sulli A, Pizzorni C et al. Nailfold videocapillaroscopy assessment of microvascular damage in systemic sclerosis. J Rheumatol 2000; 27: 155–60.
-
van den Hoogen F, Khanna D, Fransen J, et al. 2013 classification criteria for systemic sclerosis: an American College of Rheumatology/European League against Rheumatism collaborative initiative. Arthritis Rheum 2013; 72: 1747-55.
-
Minier T, Guiducci S, Bellando-Randone S, et al., the EUSTAR co-workers. Preliminary analysis of the Very Early Diagnosis of Systemic Sclerosis (VEDOSS) EUSTAR multicentre study: evidence for puffy fingers as a pivotal sign for suspicion of systemic sclerosis. Ann Rheum Dis 2014; 73: 2087-93.
-
Bellando-Randone S, Matucci-Cerinic M. Very early systemic sclerosis and pre-systemic sclerosis: definition, recognition, clinical relevance and future directions. Curr Rheumatol Rep 2017; 19 (10): 65.
-
Czirjak L, Matucci-Cerinic M. Beyond Raynaud’s phenomenon hides very early systemic sclerosis: the assessment of organ involvement is always mandatory. Rheumatology 2011; 50: 250-51.
-
Valentini G, Cuomo G, Abignano G, et al. Early systemic sclerosis: assessment of clinical and preclinical organ involvement in patients with different disease features. Rheumatology 2011; 50: 317-23.
-
Avouac J, Fransen J, Walker U, Riccieri V, Smith V, Muller C. Preliminary criteria for the very early diagnosis of systemic sclerosis: results of a Delphi Consensus Study from EULAR Scleroderma Trials and Research Group. Ann Rheum Dis 2011;70:476-81.
-
Vasile M, Avouac J, Sciarra I, et al. From VEDOSS to established systemic sclerosis diagnosis according to ACR/EULAR 2013 classification criteria: a French-Italian capillaroscopic survey. Clin Exp Rheumatol 2018; 36 Suppl 113:82-87.
-
Koenig M, Joyal F, Fritzler MJ, Roussin A, Abrahamowicz M, Boire G, et al. Autoantibodies and microvascular damage are independent predictive factors for the progression of Raynaud’s phenomenon to systemic sclerosis. Arthritis Rheum 2008; 58: 3902-12.
-
Ingegnoli F, Boracchi P, Gualtierotti R, Lubatti C, Meani L, Zahalkova L, et al. Prognostic model based on nailfold capillaroscopy for identifying Raynaud’s phenomenon patients at high risk for the development of a scleroderma spectrum disorder: PRINCE (prognostic index for nailfold capillaroscopic examination). Arthritis Rheum 2008; 58: 2174-82.
-
Herrick A, Cutolo M. Clinical implications from capillaroscopic analysis in patients with Raynaud’s phenomenon and systemic sclerosis. Arthritis Rheum 2010; 62: 2595–604.
-
Ingegnoli F, Ardoino I, Boracchi P, Cutolo M; EUSTAR co-authors. Nailfold capillaroscopy in systemic sclerosis: data from the EULAR scleroderma trials and research (EUSTAR) database. Microvasc Res 2013; 89:122-8.
-
Sebastiani M, Manfredi A, Vukatana G, Moscatelli S, Riato L, Bocci M, et al. Predictive role of capillaroscopic skin ulcer risk index in systemic sclerosis: a multicentre validation study. Ann Rheum Dis 2012; 71: 67-70.
-
Minopoulou I , Theodorakopoulou M , Boutou A, et al. Nailfold Capillaroscopy in Systemic Sclerosis Patients with and without Pulmonary Arterial Hypertension: A Systematic Review and Meta-Analysis. J Clin Med 2021; 10: 1528
-
Kooranifar, Naghshin R, et al. Diagnostic value of chest spiral CT scan and Doppler echocardiography compared to right heart catheterization to predict pulmonary arterial hypertension in patients with scleroderma. Acta Biomed 2021; 92: e2021074.
-
Sulli A, Secchi ME, Pizzorni C, Cutolo M. Scoring the nailfold microvascular changes during the capillaroscopic analysis in systemic sclerosis patients. Ann Rheum Dis 2008; 67: 885-7.
-
Cestelli V, Manfredi A, Sebastiani M, Praino E, Cannarile F, Giuggioli D, Ferri C. Effect of treatment with iloprost with or without bosentan on nailfold videocapillaroscopic alterations in patients with systemic sclerosis. Modern Rheumatology 2017; 27: 110-14.
-
Caramaschi P, Volpe A, Pieropan S, et al. Cyclophosphamide treatment improves microvessel damage in systemic sclerosis. Clin Rheumatol 2009; 28: 391-5
-
Smith V, Pizzorni C, Riccieri V, S. Decuman G, et al. Stabilization of microcirculation in patients with early systemic sclerosis with diffuse skin involvement following rituximab treatment: an open-label study. J Rheumatology 2016; 43: 995-6.
-
Miniati I, Guiducci S, Conforti ML, et al. Autologous stem cell transplantation improves microcirculation in systemic sclerosis. Ann Rheum Dis 2009; 68: 94-8.
