ARTRITE REUMATOIDE: RUOLO DELLA TOMOGRAFIA COMPUTERIZZATA NELLO STUDIO DELL’INFEZIONE POLMONARE DA COVID-19
AUTORI:
1Fausto Salaffi,2Marina Carotti,2Alessandra Borgheresi,2Andrea Agostini,2Andrea Giovagnoni
Introduzione
Il nuovo coronavirus del 2019 (2019-nCoV), responsabile dell’epidemia in corso – che l’Organizzazione Mondiale della Sanità (OMS) ha dichiarato emergenza sanitaria pubblica internazionale – prende il nome dalla famiglia di virus a cui appartiene. Il nome “coronavirus” deriva dal termine latino “corona”, a sua volta derivato dal greco κορώνη (korṓnē, “ghirlanda”), che significa “corona” o “aureola”. Ciò si riferisce all’aspetto caratteristico dei virioni (la forma infettiva del virus) visibile al microscopio elettronico, che presenta una frangia di grandi proiezioni superficiali bulbose che creano un’immagine che ricorda una corona reale o della corona solare. I coronavirus sono stati scoperti negli anni sessanta dalle cavità nasali dei pazienti con raffreddore comune. Questi virus furono successivamente chiamati Human Coronavirus 229E (HCoV-229E) e Human Coronavirus OC43 (HCoV-OC43). Sono stati identificati altri due membri di questa famiglia (Human Coronavirus NL63 (HCoV-NL63) nel 2004 e Human Coronavirus HKU1 (HCoV-HKU1) nel 2005) e sono stati coinvolti in infezioni del tratto respiratorio più gravi. I coronavirus sono stati responsabili delle gravi epidemie di SARS del novembre 2002, di quella della MERS del 2012 e della polmonite di Wuhan del 2019-2020 (Luo CM et al. J Virol. 2018). Il ceppo di Wuhan è stato identificato come un nuovo ceppo di β-CoV dal Gruppo 2B con una somiglianza genetica del 70% circa rispetto al SARS-CoV. Il nuovo ceppo, di conseguenza, è stato nominato SARS-CoV-2. I coronavirus sono un genere di virus a RNA che fanno parte della sottofamiglia Orthocoronavirinae, della famiglia Coronaviridae, del sottordine Cornidovirineae, dell’ordine Nidovirales. Si tratta di virus dotati di pericapside con un genoma a filamento singolo a senso positivo e con un nucleocapside di simmetria elicoidale (Almeida JD et al. Intervirology. 1975). La dimensione genomica dei coronavirus varia da circa 26 a 32 kilobasi, la più grande per un virus a RNA (Cui J, et al. Nat Rev Microbiol. 2019). I coronavirus sono una vasta famiglia di virus che causano infezioni nell’uomo e in una varietà di animali tra cui uccelli e mammiferi. Quando i coronavirus animali si evolvono, possono infettare le persone e poi diffondersi da persona a persona, attuando il cosìdetto “salto di specie” e causando focolai di malattia, come è accaduto in passato per la Sindrome Respiratoria Mediorientale (MERS-CoV) e la Sindrome Respiratoria Acuta Grave (SARS). Il ceppo SARS-CoV-2, così denominato dall’International Committee on Taxonomy of Viruses, è risultato geneticamente identico per il 96% ad un noto coronavirus dei pipistrelli e per l’86-92% ad un coronavirus del pangolino. Per la MERS gli studi condotti hanno indicato i dromedari come serbatoi del virus che sporadicamente possono infettare l’uomo, e per la SARS, le evidenze epidemiologiche hanno confermato una vasta gamma di possibili serbatoi del virus (come zibetti, furetti e pipistrelli), in grado di trasmettere l’infezione all’uomo. Di contro, esistono anche numerosi coronavirus che circolano negli animali e che non hanno ancora infettato l’uomo o, infine, come in questo caso il virus può essere infettivo per l’uomo, ma non trasmettersi agli animali domestici (Song Z et al. Viruses. 2019). COVID-19 è un’emergenza sanitaria esplosa in Italia dal 21 febbraio 2020 che ha richiesto alle Istituzioni Sanitarie uno sforzo organizzativo urgente, in relazione alle pesanti implicazioni cliniche e alle imprevedibili ripercussioni sulla sanità pubblica che ha comportato. Allo stato attuale delle conoscenze, sappiamo che il virus SARS-CoV-2 coinvolge, specificamente, l’apparato respiratorio, dando origine a una presentazione clinica che può variare da forme asintomatiche/paucisintomatiche fino a una grave polmonite interstiziale bilaterale con danno alveolare diffuso (Wang Y et al. J Med Virol. 2020).
L’evoluzione della pandemia
Il 31 dicembre 2019 la Commissione Sanitaria Municipale di Wuhan (Cina) ha segnalato all’Organizzazione Mondiale della Sanità (OMS) un cluster di casi di polmonite ad eziologia ignota nella città di Wuhan, nella provincia cinese di Hubei. La maggior parte dei casi aveva un legame epidemiologico con il mercato di Huanan Seafood, nel sud della Cina, ossia un mercato all’ingrosso di frutti di mare ed animali vivi. Il 9 gennaio 2020, il Center for Disease Control (CDC) cinese ha riferito che è stato identificato un nuovo coronavirus (il SARS-CoV-2 o Novel Coronavirus o Coronavirus di Wuhan), come agente causale della malattia respiratoria poi denominata COVID-19 (coronavirus disease 2019) (Rothan HA, et al. J Autoimmun. 2020). La Cina ha reso pubblica la sequenza genomica virale che ha permesso la realizzazione di un test diagnostico in modo tempestivo. Nel mese gennaio 2020, COVID-19 si è era diffusa in tutte le principali città della Cina e registrava alcuni casi anche in altri paesi del Mondo (erano per lo più turisti o persone che per lavoro si erano recate in Cina poco prima dello scoppio dell’epidemia). Da allora, come ben sappiamo, si è verificata una crescita esponenziale di contagi, che ha coinvolto, dapprima i paesi limitrofi, quali Giappone e Corea del Sud, fino ad interessare paesi extra-continentali, con i primi casi documentati in Europa, Stati Uniti e Africa tra gennaio e febbraio 2020 (https://coronavirus.jhu.edu/map.html). Il 30 gennaio 2020 l’OMS dichiarava l’epidemia un’emergenza globale. Il 21 febbraio 2020 esplodeva l’epidemia in Italia, il 10 marzo veniva dichiarata la pandemia. Il numero di infetti e di morti è in continuo aggiornamento e può essere seguito in tempo reale nel sito dell’European Centre for Disease Prevention and Control (ECDC) (https://www.ecdc.europa.eu/en/covid-19-pandemic), del World Health Organization (WHO) (https://www.who.int/emergencies/diseases/novel-coronavirus-2019/situation-reports) e dell’OMS (https://www.who.int/csr/disease/coronavirus_infections/fr/). I focolai in Italia sono, al momento, un’eccezione in Europa. Dopo Cina e Corea del Sud l’Italia è il paese al mondo con più casi di CoVID-19 ((https://coronavirus.jhu.edu/map.html). In particolare, alla data del 27 febbraio 2020, i casi confermati da laboratorio secondo l’ECDC sono 82.132 nel mondo. Di questi, 78.528 sono stati accertati in Cina, i restanti in una quarantina di altri Paesi. Nel mondo sono 2.245.872 i casi confermati dall’inizio dell’epidemia e sono 152.707 le persone ufficialmente decedute a causa del coronavirus. Il contatore dell’università americana piazza il numero globale di guariti a oltre 140.200, 12.384 dei quali in Italia, seconda in questa classifica dopo la Cina (oltre 75.500 guariti). Sono stati, anche registrati 2 casi in Africa (1 in Egitto e 1 in Algeria). Si teme che anche focolai limitati potrebbero costituire nel continente africano un drammatico problema globale per la debolezza delle infrastrutture e dei sistemi sanitari. Nella Figura 1 viene riportata l’evoluzione dei contagi nei paesi più colpiti (aggiornato al 19 aprile 2020, ore 10 (Fonte: Johns Hopkins Center for System Science and Engineering) (https://coronavirus.jhu.edu/map.html)
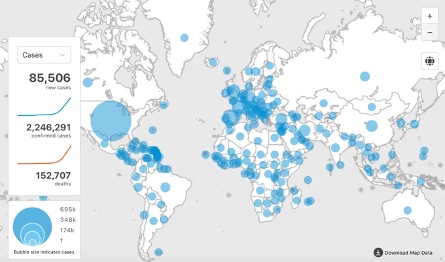
Figura 1. Coronavirus, l’evoluzione dei contagi nei paesi piu’ colpiti (aggiornato al 20 aprile 2020, ore 10 (Fonte: Johns Hopkins Center for System Science and Engineering – (https://coronavirus.jhu.edu/map.html)
Gli ultimi dati dell’OMS, inclusa Italia (fonte Dashboard Who European Region, 20 Aprile, ore 10) (https://qap.ecdc.europa.eu/public/extensions/COVID-19/COVID-19.html) hanno documentato in Europa la presenza di 1.089.256 contagiati e di 101.836 pazienti deceduti a causa dell’infezione da coronavirus e di 309.495 pazienti guariti (Figura 2).
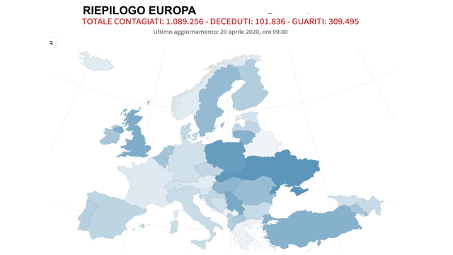
Figura 2. Coronavirus, la situazione in Europa (aggiornato al 19 aprile 2020, ore 10 (Fonte: Johns Hopkins Center for System Science and Engineering) (https://qap.ecdc.europa.eu/public/extensions/COVID-19/COVID-19.html)
Il 21 Febbraio 2020 esplodeva l’epidemia in Italia, che fino a quella data contava solo 3 casi. Stando agli ultimi dati nazionali – aggiornati al 18.04.2020 – si contano 178.972 casi totali dall’inizio della pandemia. Le persone attualmente positive sono 108.257, 23.660 deceduti e 47.055 guariti (Figura 3). L’Italia è, attualmente, il primo Paese in Europa per numero di contagi e il quinto nel mondo dopo Cina, Corea del Sud, Giappone e Singapore. L’intera classe medica nazionale, per questo motivo, si trova ad affrontare in prima linea l’emergenza sanitaria che è in corso.
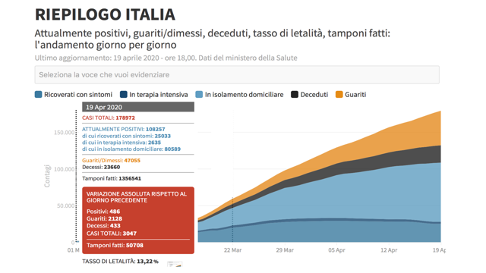
Figura 3. Figura 3. Coronavirus, la situazione in Italia (aggiornato al 19 aprile 2020 alle ore 18.00) (https://coronavirus.jhu.edu/map.html)
Aspetti clinici
I pazienti con infezione da COVID-19, possono presentare diversi fenotipi clinici, che variano dall’infezione asintomatica, alla sindrome da distress respiratorio acuto (ARDS) sino allo shock settico (http://giviti.marionegri.it).
La presentazione clinica risulta essere quanto mai eterogenea; circa l’80% dei pazienti mostra un quadro clinico lieve, il 15% sviluppa una forma grave (dispnea, tachipnea, P/F < 300, infiltrati polmonari bilaterali > 50%), mentre il restante 5% si presenta critico (insufficienza respiratoria grave, shock) (Kolifarhood G, et al. Arch Acad Emerg Med. 2020).
Il sintomo in assoluto più frequentemente riportato è la febbre, che può essere assente nella metà circa dei pazienti al momento della prima osservazione, ma che si sviluppa in quasi il 90% dei casi durante l’ospedalizzazione. Il decorso febbrile nei pazienti con COVID-19 non è ancora ben compreso, ma sembra che possa essere continuo o intermittente. Anche la tosse è spesso presente (67,8%), più frequentemente secca, ma che può diventare produttiva in oltre un terzo dei pazienti. E’ possibile, inoltre, documentare una sintomatologia aspecifica, come astenia (38.1%), mialgie/artralgie (14.9%) e, meno frequentemente, cefalea, mal di gola ed emottisi. Più raro è, invece, il coinvolgimento delle mucose nasali e congiuntivali, come risultano infrequenti anche sintomi del tratto gastro-enterico (Kolifarhood G, et al. Arch Acad Emerg Med. 2020). In Tabella 1 sono riportati, in percentuale, i sintomi non specifici, all’esordio dell’infezione.

Il più severo quadro clinico risulta essere la polmonite virale, caratterizzata da febbre, tosse, dispnea e con un quadro radiologico caratterizzato da infiltrati bilaterali. I pazienti con COVID-19 in condizioni critiche sviluppano, spesso, una sindrome da distress respiratorio acuto e danno polmonare acuto (ARDS/ALI). L’infiammazione progressiva incontrollata nei polmoni provoca un danno alveolare diffuso acuto (DAD), riconosciuto alla TC come aree con opacità “a vetro smerigliato” e aree con densità aumentata di tipo consolidativo (Lai CC, et al. Int J Antimicrob Agents. 2020). Quando l’ARDS progredisce nella fase acuta, si osservano edema, infiammazione interstiziale e atelettasia da compressione, con riduzione del volume del gas polmonare (Sorbello M, et al. Anaesthesia. 2020). I pazienti COVID-19 che soffrono di ARDS / ALI, spesso necessitano di intubazione e ventilazione meccanica invasiva per sopperire alla difficoltà respiratoria, in quanto, la crescente insufficienza respiratoria ipossiemica provoca un danno alveolare diffuso acuto (Yao W, et al. Br J Anaesth. 2020). La sindrome ARDS e l’ALI, sono, spesso, caratterizzati dall’accumulo di neutrofili a livello polmonare e dall’aumentata produzione di citochine infiammatorie, di chemochine, di proteasi ed ossidanti. La fase di esordio e lo sviluppo di ARDS / ALI dipende dall’attivazione degli inflammasomi. Gli inflammasomi sono parte integrante del nostro sistema immunitario innato. L’attivazione degli inflammasomi rilascia citochine pro-infiammatorie, quali l’interleuchina (IL)-1β e IL-18. Recentemente, l’inflammasoma NLRP3 è stato identificato come fattore chiave per l’induzione di ADRS/ALI (Giamarellos-Bourboulis EJ, et al. Cell Host Microbe. 2020). L’interleuchina 1 beta (IL-1β) è una potente citochina pro-infiammatoria che è implicata nella patogenesi della sindrome ARDS, in quanto l’ipossiemia è indotta dall’attivazione di IL-1β (Deftereos SG, et al. Hellenic J Cardiol. 2020). Una ARDS/ALI si manifesta nel 17-29% dei pazienti ospedalizzati, con un tempo di insorgenza dalla presentazione dei sintomi di circa 8 giorni (Huang C, et al. Lancet 2020). Il 10% circa sviluppa un’infezione secondaria (Chen N, et al. Lancet 202). Circa il 20-30% dei pazienti ospedalizzati per polmonite richiedono un trattamento intensivo con supporto respiratorio (Wu Z, et al. JAMA. 2020). Tali pazienti, rispetto a quelli che non necessitano di terapia intensiva, risultano essere più anziani (età media 66 anni contro 51 anni) ed hanno più probabilità di avere comorbilità sottostanti (72% contro 37% rispettivamente) (Wang D, et al. JAMA. 2020). Anche il tasso di letalità, nei pazienti over 60 anni cresce con l’aumentare dell’età (60-69 anni: 3.6%; 70-79 anni: 8%; ≥80 anni: 14.8%). I pazienti senza comorbidità presentano un tasso di letalità (proporzione percentuale di decessi per una determinata malattia sul totale dei soggetti ammalati in un determinato arco temporale) dello 0,9% che cresce al 10.5% nei pazienti con patologie cardiovascolari, 7% nei diabetici e 6% nei pazienti affetti di ipertensione, cancro e pneumopatia cronica. Fra i pazienti che sviluppavano insufficienza respiratoria e shock settico il tasso di letalità è pari al 49% (Novel Coronavirus Pneumonia Emergency Response Epidemiology Team. Zhonghua Liu Xing Bing Xue Za Zhi 2020).
Dai dati rilevati dall’epidemia di COVID-19, avvenuta su di una nave da crociera, dove pressoché tutti i membri dell’equipaggio ed i passeggeri sono stati testati per SARS-CoV-2, circa il 17% della popolazione a bordo è risultata positiva; dei 619 individui risultati positivi, circa la metà era asintomatica al momento della diagnosi. Nella popolazione pediatrica, le informazioni circa la presentazione clinica, il decorso ed i fattori di rischio per lo sviluppo di forme gravi sono al momento limitate. Nella popolazione cinese, solo il 2,1% dei pazienti con COVID-19 aveva meno di 20 anni, e non è stato riportato alcun decesso al di sotto dei 10 anni di età. Dai dati attualmente disponibili, la sintomatologia nei bambini sembra essere più lieve, rispetto a quella sviluppata dagli adulti, la maggior parte dei quali si presenta con febbre, tosse, congestione nasale e rinorrea (Wei M, et al. JAMA. 2020); soltanto un caso è esordito con sintomi gastro-enterici ed ha poi sviluppato una forma respiratoria grave (Chen F, et al. Zhonghua Er Ke Za Zhi 2020). Agli esami di laboratorio il reperto più frequente è rappresentato dalla linfocitopenia (83%), mentre la leucopenia e la trombocitopenia si rilevano in un terzo circa dei casi. La maggior parte dei pazienti presenta, inoltre, elevati livelli di proteina C-reattiva (PCR). Meno frequenti, ma comunque rilevabili, sono l’incremento delle transaminasi, dell’LDH e del D-dimero, mentre più rari risultano essere l’incremento di CPK, creatinina e pro-calcitonina. Tutte queste alterazioni di laboratorio, inoltre, sono generalmente lievi-moderate, ma l’entità delle alterazioni è tanto maggiore quanto più grave è il decorso (Fu L, et al. J Infect. 2020). Le caratteristiche riscontrate all’imaging, in particolare all’esame radiografico standard del torace ed alla tomografia computerizzata sono oggetto del successivo paragrafo.
Aspetti radiologici in corso di infezione polmonare da COVID-19
L’infezione da COVID-19 ha come manifestazione clinica predominante la polmonite, solitamente a carattere interstiziale nella fase di acuzie, e l’imaging gioca un ruolo rilevante nell’iter diagnostico, nel management e nel follow-up di questa malattia (Misra DP, et al. Clin Rheumatology 2020). Le polmoniti interstiziali sono caratterizzate dalla presenza di edema ed infiltrato infiammatorio cellulare, a carico dell’interstizio, fino a livello dei setti intra-lobulari, e solo nelle fasi più avanzate, si ha un riempimento alveolare con aspetto, inizialmente, di tipo “a vetro smerigliato” (ground-glass opacity: GGO) e, successivamente, a carattere consolidativo.
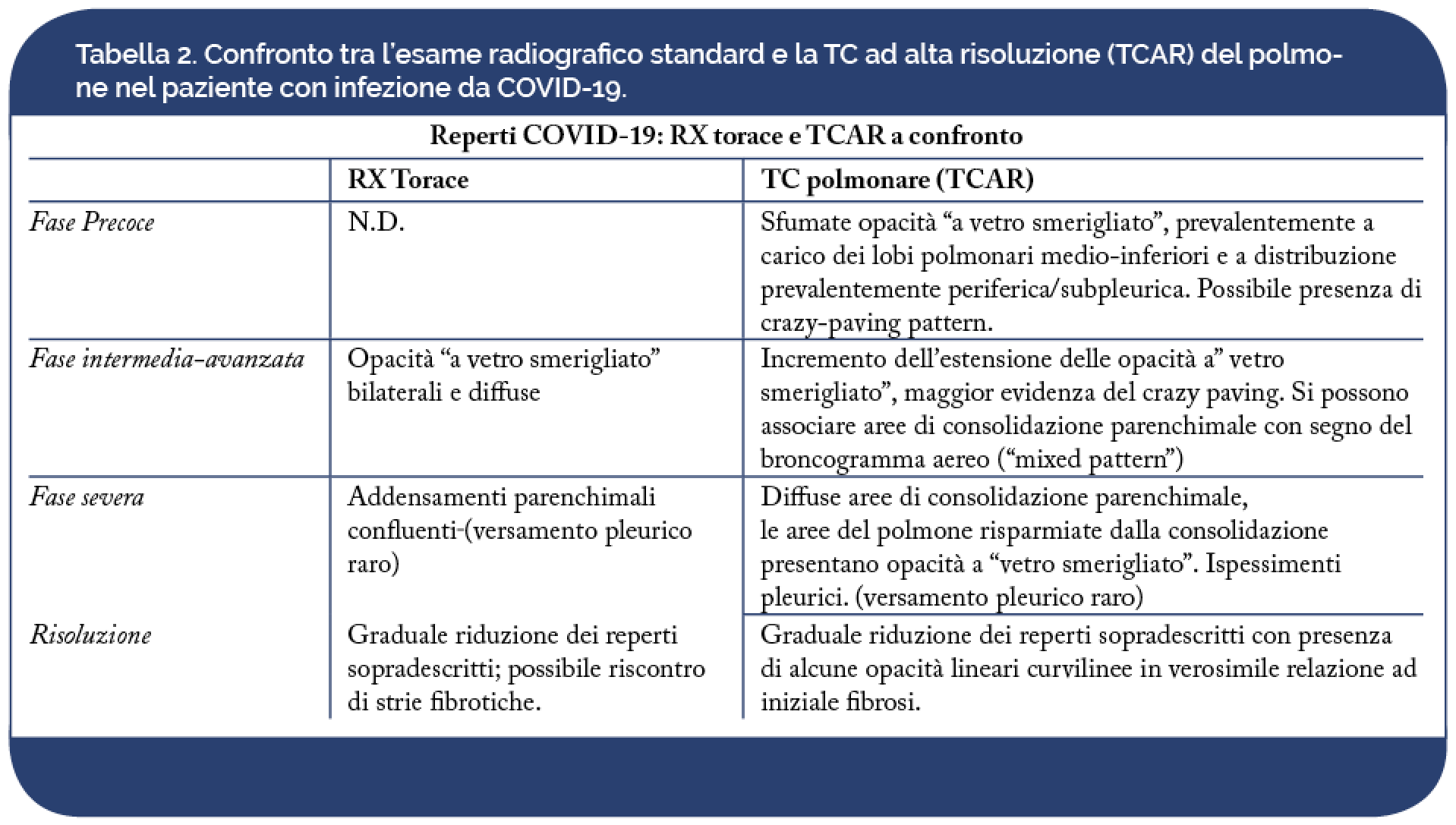
In un contesto di sintomatologia aspecifica e di quadri clinici variabili come gravità e progressione di malattia, il contributo dell’imaging può risultare determinante, non solo per la diagnosi di polmonite, ma anche per il monitoraggio della terapia e per l’individuazione dei fattori prognostici sfavorevoli. L’esame radiografico standard del torace è gravato da una bassa sensibilità nell’identificazione delle alterazioni polmonari più precoci dell’infezione polmonare da COVID-19 (Choi H et al. Radiology: Cardiothoracic Imaging, 2020, Yoon SH, et al. Korean Journal of Radiology, 2020, Ng MY, et al. Radiology: Cardiothoracic Imaging, 2010). Di contro, la TC del torace, in particolare la TC ad alta risoluzione (TCAR), è la metodica di scelta nello studio della polmonite da COVID-19, anche nelle fasi iniziali, data la sua elevata sensibilità (Yang, W., et al. Eur Radiol 2020, Bernheim A, et al. Radiology. 2020) (Tabella 2).
Esame radiografico standard del torace
L’esame radiografico standard del torace è gravato da bassa sensibilità nell’identificazione delle alterazioni polmonari più precoci della COVID-19, caratterizzate da opacità a “vetro smerigliato” (Choi H et al. Radiology: Cardiothoracic Imaging, 2020, Yoon SH, et al. Korean Journal of Radiology, 2020, Ng MY, et al. Radiology: Cardiothoracic Imaging, 2010). E’, tuttavia, necessario considerare che in molte delle infezioni polmonari acquisite in comunità, le alterazioni si rendono manifeste all’esame radiografico del torace entro un intervallo di tempo – di solito 12 ore – dall’inizio della sintomatologia e, quindi, l’esame può risultare negativo, se effettuato troppo precocemente. Nelle fasi più avanzate dell’infezione l’esame radiografico del torace mostra opacità alveolari multifocali bilaterali, che tendono alla , sino all’opacamento completo del polmone (Figura 4), con possibile falda di versamento pleurico associato (Yoon SH, et al. Korean Journal of Radiology, 2020, Wong HYF, et al. Radiology, 2020).
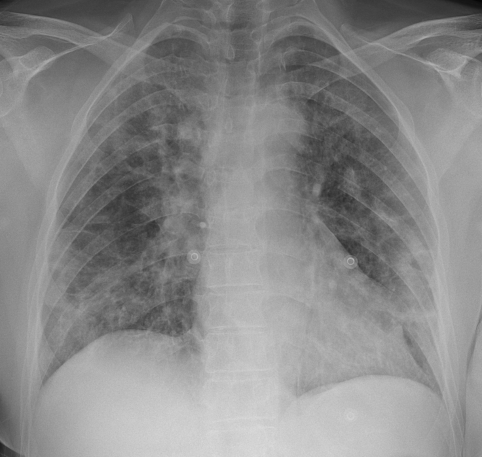
Figura 4. L’esame radiografico del torace eseguito in posizione supina mostra multipli addensamenti parenchimali interstizio-alveolari diffusi su entrambi i parenchimi polmonari.
TC ad alta risoluzione (TCAR) del polmone
La TCAR è una tecnica di tomografia computerizzata, a strato sottile (“slice thickness” compreso fra 0.625 mm e 1.25 mm), caratterizzata da elevata risoluzione spaziale. Rappresenta la tecnica gold-standard per lo studio dell’interstizio polmonare e consente l’identificazione del lobulo secondario, definito come la più piccola porzione di parenchima polmonare, delimitata da setti connettivali e delle strutture centro-lobulari.
La TCAR gioca un ruolo fondamentale nel management del paziente con COVID-19, non solo nelle prime fasi, ma anche nella valutazione del decorso e della severità della malattia e delle eventuali complicanze (Pan F, et al. Radiology, 2020).
Le modificazioni del quadro radiologico polmonare nella COVID-19 si verificano precocemente ed il riconoscimento, da parte del radiologico, delle caratteristiche più tipiche di questa infezione polmonare, sia nelle fasi iniziali che nel follow-up, ne facilita la diagnosi. Inoltre, la TCAR consente di valutare la completa risoluzione delle alterazioni polmonari e l’identificazione di possibili re-infezioni. La polmonite da COVID-19, tuttavia, mostra un quadro TCAR diversificato ed aspecifico, simile ad altre infezioni polmonari, come quella da influenza A, da citomegalovirus, da altri coronavirus (SARS, MERS), da streptococco e dalle polmoniti indotte da germi atipici (clamidia, micoplasma). L’impegno della malattia polmonare da COVID-19 è prevalentemente bilaterale, con netta predominanza dei segmenti posteriori e coinvolgimento plurilobare più frequente del singolo lobo (44,4% vs 30,2%). Sono, inoltre, riscontrabili alterazioni “a vetro smerigliato”, più frequentemente che consolidazioni parenchimali (85% vs 19%). Nelle fasi precoci dell’infezione (entro circa 3 giorni), l’esame TC mostra, generalmente, la comparsa di aree focali di aspetto a “vetro smerigliato”, a morfologia rotondeggiante, in sede sub-pleurica periferica. L’ aspetto a “vetro smerigliato”, risulterebbe, pertanto, il primo reperto TCAR a comparire nella fase precoce di malattia. Nelle fasi più tardive, si assiste alla comparsa ed all’incremento delle aree consolidative. Bernheim et al. (Bernheim A, et al. Radiology. 2020) analizzando, retrospettivamente, le indagini TCAR di 121 pazienti con diagnosi confermata di COVID-19, effettuata a vari intervalli temporali, hanno osservato che il danno polmonare acuto correla con l’iniziale comparsa di aree di aumentata densità con aspetto “a vetro smerigliato”, che tendono progressivamente a confluire ed aumentare di densità, con aspetto di consolidazioni, con predilezione per le zone sub-pleuriche periferiche. Pan et al. (Pan F, et al. Radiology, 2020) hanno tenuto sotto osservazione 21 pazienti della loro coorte, effettuando esami TCAR ripetuti a distanza di 4 giorni e hanno individuato 4 stadi dell’infezione: precoce, progressione, picco e risoluzione. La progressione della malattia correla con l’aumento del numero, delle dimensioni e della densità delle aree di aspetto a “vetro smerigliato”, agli esami TCAR, con comparsa di consolidazioni parenchimali diffuse e bilaterali con broncogramma aereo nel contesto. La comparsa di estese consolidazioni parenchimali alla TCAR correlava con la severità dell’infezione, come dimostrato in tutti i pazienti in condizioni cliniche severe. Uno studio su 81 pazienti di Wuhan ha provato a suddividere i pazienti in gruppi in base alla distanza temporale tra comparsa dei sintomi ed esecuzione della TC torace (Shi H, et al. Lancet Infectious Diseases, 2020). In fase subclinica, con paziente asintomatico, prevalevano lesioni di tipo a “vetro smerigliato”, unilaterali, focali o multifocali; nei soggetti sintomatici sottoposti a TCAR alla prima settimana le lesioni apparivano più estese, con prevalenza di aspetto a “vetro smerigliato”, e comparsa di componenti consolidative. Nelle fasi più tardive si riscontrava con maggior frequenza il pattern “crazy paving”, caratterizzato dalla presenza di aree di aspetto a “vetro smerigliato”, sovrapposte ad ispessimento liscio dell’interstizio interlobulare ed intralobulare, e il “reversed halo sign” (area focale di aspetto a “vetro smerigliato”, delimitata da anello periferico ± completo di consolidazione). Altri reperti erano le cavitazioni, le calcificazioni, le linfoadenopatie e il versamento pleurico. Tuttavia le linfoadenopatie sono risultate poco frequenti (14,4%) (Yang, W., et al. Eur Radiol 2020, Bernheim A, et al. Radiology. 2020). La Figura 5 sotto riportata riassume i vari reperti TC della polmonite COVID-19 e la frequenza di riscontro in 3.866 pazienti delle coorti studiate nei lavori recentemente pubblicati sull’argomento.
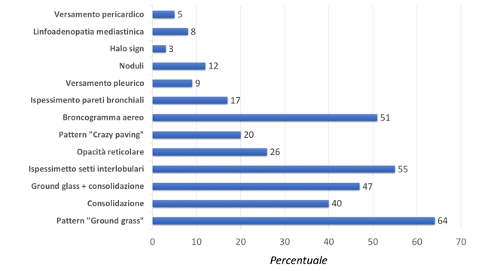
Figura 5. Principali pattern TCAR rilevati in letteratura su 3863 pazienti affetti da polmonite da COVID-19
Semeiotica dei principali pattern TCAR in pazienti con polmonite da COVID-19
In base a quanto riportato in letteratura, la polmonite da SARS-CoV-2 presenta manifestazioni diverse a seconda della fase e del grado di severità della malattia. La TCAR rappresenta uno strumento utile nel monitoraggio di questi pazienti, permettendo una valutazione del decorso della patologia e un rapido riconoscimento di eventuali complicanze. Segno caratteristico, ma non specifico, di COVID-19 sono le aree di aspetto a “vetro smerigliato”, che compaiono nelle prime fasi della malattia. Alla TCAR le arre di aspetto a “vetro smerigliato”, hanno una distribuzione bilaterale, a volte asimmetrica, prevalente basale, generalmente a sede posteriore, periferica. In fase molto iniziale, quando il paziente è paucisintomatico o asintomatico, le aree di aspetto a “vetro smerigliato”, possono avere localizzazione monolaterale. In questa fase le aree di aspetto a “vetro smerigliato”, tendono ad avere forma rotondeggiante. Già in questa fase precoce nel contesto delle aree di aspetto a “vetro smerigliato” è possibile osservare ectasie vascolari (“vascular dilatation sign”), ancora di incerta interpretazione; come cause sono stati ipotizzati iperafflusso vascolare nella zona di polmone patologica, shunt vacolari o microangiopatia trombotica (Caruso D, et al. Radiology, 2020, Oudkerk M, et al. Radiology, 2020). Con il progredire della malattia le aree di aspetto a “vetro smerigliato” tendono ad aumentare di numero ed estensione, interessando sia la periferia che le aree centrali del polmone e ad incrementare di densità con aspetti consolidativi e si ha pertanto un quadro misto. In questa fase possono associarsi altri reperti, quali l’ispessimento dei setti interlobulari, il “crazy-paving pattern”, il segno dell’atollo (o “reversed halo sign”), le alterazioni delle vie aeree, la distorsione architetturale, la riduzione del volume polmonare, il versamento pleurico e pericardico, il pneumotorace e le linfoadenomegalie. Nella fase di remissione le aree di consolidazione parenchimale si riassorbono gradualmente dando esito a strie fibrotiche. Tali reperti in TCAR sono verosimilmente riconducibili ai meccanismi patologici di danno polmonare causati dalla patologia e possono essere utili nel differenziare la polmonite da COVID-19 da altre indotte da diverse cause eziologiche.
Opacità a vetro smerigliato. Le opacità “a vetro smerigliato” si definiscono come sfumate aree di incrementata densità parenchimale, tale da non impedire la visualizzazione delle strutture bronco-vascolari sottostanti (Figura 6). Si tratta di un reperto aspecifico. Il meccanismo patologico sottostante probabilmente è dovuto ad un parziale riempimento degli spazi alveolari o all’ispessimento dei setti interstiziali intra-lobulari. Dai pochi dati istopatologici si suppone che già nelle fasi iniziali le GGO siano espressione di danno polmonare diffuso (DAD/ALI) (Oudkerk M, et al. Radiology, 2020, Guan CS, et al. Academic Radiology, 2020). Le aree di aspetto a “vetro smerigliato” insieme alle aree di consolidazione, rappresentano il reperto radiologico più frequente in corso di COVID-19; tuttavia, bisogna tenere in considerazione che i reperti TC possono variare da paziente a paziente e in base a diversi stadi della malattia. Bernheim et al. (Bernheim A, et al. Radiology. 2020) riporta che il 56% delle TC dei pazienti in fase “precoce” (ovvero, la TC eseguita entro 0-2 giorni dall’esordio dei sintomi) sono risultate normali; mentre, solo il 9% dei pazienti in fase “intermedia” (3-5 giorni da esordio sintomi) e il 4% dei pazienti in fase “avanzata” (6-12 giorni) mostravano una TC con reperti normali. Anche Pan et al (Pan F, et al. Radiology, 2020) hanno evidenziato che nei primi stadi di malattia è presente una netta predominanza delle aree di aspetto a “vetro smerigliato” e che entro le due settimane dall’ esordio dei sintomi (picco a 10 giorni) si assiste alla comparsa del pattern crazy-paving e di aree consolidative. Wang et al. (Wang D, et al. JAMA. 2020) confermano che le aree di aspetto a “vetro smerigliato” rappresentano il reperto più frequente, seguito dall’associazione fra le GGO opacità e aree di consolidazione; tale condizione è più evidente a 6-11 giorni dall’esordio dei sintomi (24%). Gli stessi autori (Wang D, et al. JAMA. 2020) hanno evidenziato una pressoché costante presenza delle GGO durante tutto il decorso della malattia, con una prevalenza diversa durante le varie fasi: inizialmente è presente una netta predominanza delle aree di aspetto a “vetro smerigliato”, rispetto agli altri reperti. Con la successiva comparsa delle aree di consolidazione si assiste ad una riduzione delle aree di aspetto a “vetro smerigliato” e viceversa nelle fasi successive. Da riscontri autoptici su pazienti COVID-19, è stato suggerito come possibile meccanismo patologico relativo alle aree “a vetro smerigliato”, la presenza di edema polmonare e di membrane. Numerose osservazioni hanno documentato la coesistenza delle aree di aspetto a “vetro smerigliato” con l’ispessimento dei setti interlobulari e le aree di consolidazione parenchimale; tali reperti suggeriscono, pertanto, la presenza di patterns di polmonite organizzativa da danno parenchimale.
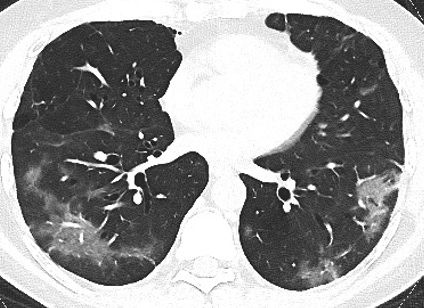
Figura 6. Scansione assiale TC che mostra aree di iperdensità parenchimale di tipo “a vetro smeriglito” a carico di entrambi i lobi polmonari inferiori. A destra nel contesto dell’area a “vetro smerigliato” è possibile osservare ectasie vascolari (“vascular dilatation sign”).
Aree di Consolidazione. Le aree di consolidazione sono il risultato della completa sostituzione dello spazio aereo alveolare da parte di liquido o materiale cellulare patologico che determina un incremento della densità parenchimale tale da non rendere più distinguibili i vasi e le pareti bronchiali (Figura 7). Caratteristicamente, le aree di consolidazione sono presenti dal 2 al 64% dei casi, possono essere multifocali, a chiazza o segmentali, con una distribuzione sub-pleurica o peri-bronco-vascolare. Nel COVID-19, il meccanismo patologico relativo alla formazione delle aree di consolidazione potrebbe riferirsi alla presenza di essudato cellulare fibro-mixoide all’interno degli spazi alveolari. Come già menzionato, lo sviluppo di aree di consolidazione entro due settimane dallo sviluppo dei sintomi potrebbe essere in relazione alla progressione della patologia; questo dato concorda con quanto riportato in un altro studio che dimostra che le aree di aspetto a “vetro smerigliato” precedono o coesistono con le aree di consolidazione nel periodo 1-3 settimane dall’inizio dei sintomi. Dato che queste alterazioni sono più frequenti nel periodo intermedio-tardivo della patologia o nei pazienti di età superiore ai 50 anni, la loro presenza potrebbe essere considerata come un segno da tenere in considerazione nella gestione dei pazienti.
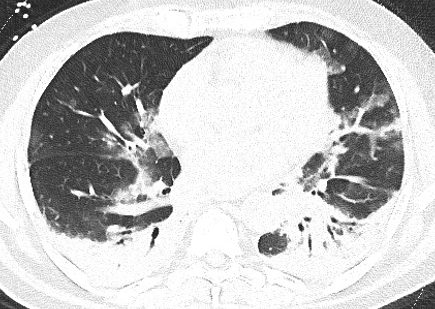
Figura 7. Scansione assiale TC che mostra estese aree di consolidazione parenchimale a carico di entrambi i lobi polmonari inferiori, con broncogrammi aerei nel contesto. A destra nel contesto dell’area consolidativa è possibile apprezzare una bronchiectasia. Aree di iperdensità parenchimale di tipo “ a vetro smerigliato” sono apprezzabili a carico del lobo medio e della lingula.
Pattern Reticolare. Con pattern reticolare si intende la presenza di una rete complessa di opacità lineari parenchimali, che sono il risultato dell’ispessimento dei setti interlobulari e intralobulari (Figura 8), dovuto a infiltrazione linfocitaria. Il pattern reticolare è il terzo reperto più frequente nel COVID-19 dopo le aree di aspetto a “vetro smerigliato” e le aree di consolidazione, e la sua incidenza incrementa con il progredire della patologia.
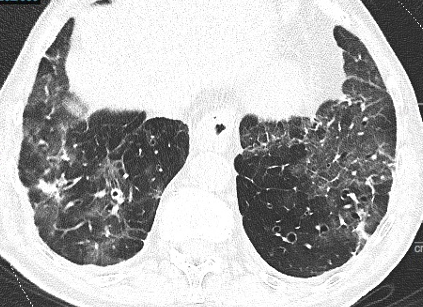
Figura 8. Scansione assiale TC che mostra ispessimento dell’interstizio con pattern reticolare a carico di entrambi i lobi inferiori. Si associano aree di iperdensità parenchimale di tipo “a vetro smerigliato” bilateralmente. A destra, si evidenziano ispessimento delle pareti bronchiali, piccola area consolidativa ed ispessimento pleurico.
Crazy-paving. Il “crazy-paving pattern” consiste nella presenza di ispessimento dei setti interlobulari con sovrapposta area di aspetto a “vetro smerigliato”, immagine che ricorda una piastrellatura di mattonelle irregolari (Figura 9). Nella polmonite da SARS-CoV-2, questo reperto risulta meno frequente delle GGO e delle aree di consolidazione. Il possibile meccanismo patologico sottostante, come già riportato nella SARS, potrebbe essere in relazione alla contemporanea presenza di infiammazione delle strutture interstiziali ed edema alveolare. Il “crazy paving pattern” viene riportato nel 5~36% dei pazienti affetti da COVID-19 e, qualora associato alle aree di aspetto a “vetro smerigliato” ed alle aree di consolidazione, si può considerare come un segno di progressione o del picco della patologia.
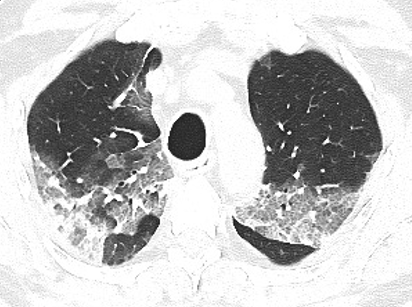
Figura 9. Scansione assiale TC che mostra aree di iperdensità parenchimale tipo “crazy-paving pattern” a carico di entrambi i lobi polmonari superiori, con tendenza alla consolidazione in sede posteriore a destra. Piccola area di iperdensità parenchimale di tipo “a vetro smerigliato” a carico del lobo polmonare superiore destro, in sede anteriore.
Broncogramma aereo. Con “segno del broncogramma aereo” si intende un fenomeno in cui i bronchi inclusi nel contesto di un’area parenchimale di elevata attenuazione, appaiono ben visibili grazie alla presenza di aria al loro interno (Figura 7). Questo segno è stato descritto in associazione al COVID-19; tuttavia, è stato dimostrato che in realtà i bronchi sono ripieni di muco gelatinoso e presentano una lieve dilatazione. Pertanto, si è suggerito che il termine di “broncogramma aereo” possa essere inappropriato in questo caso: i bronchi inclusi nella consolidazione non sono in effetti pieni di aria. Per queste ragioni viene più appropriatamente utilizzata la definizione di “bronchioloectasie”, essendo ipotizzato che l’elevata viscosità del muco possa contribuire al danno bronchiolare e causare bronchiectasie e la caratteristica tosse secca dei pazienti affetti da COVID-19.
Modificazione delle vie aeree. Sono state descritte delle modificazioni delle vie aeree relative al COVID-19. Nello specifico, l’ispessimento delle pareti bronchiali è stato riportato dal 10 al 20% dei casi, cui si associa in alcuni casi la presenza di bronchiectasie (Figura 7). Il meccanismo patologico assunto implica l’ostruzione bronchiale con danno infiammatorio delle pareti, che determina distruzione delle pareti bronchiali, sviluppo di fibrosi e conseguenti bronchiectasie da trazione. A supporto di questo, uno studio recentemente pubblicato, riporta una maggiore rappresentazione di questo reperto nei pazienti COVID-19 severo/critici.
Alterazioni pleuriche. L’alterazione pleurica più frequentemente riportata nei pazienti COVID-19 non è il versamento pleurico (presente nel 5% dei casi) (Figura 10), ma l’ispessimento pleurico (32% dei casi) , la cui presenza in TC sembra trovare conferma nei reperti autoptici. In modo analogo a quando riportato per l’infezione da Middle East Respiratory Syndrome Coronavirus (MERS-CoV), la presenza di versamento pleurico sembrerebbe rappresentare un fattore prognostico negativo.
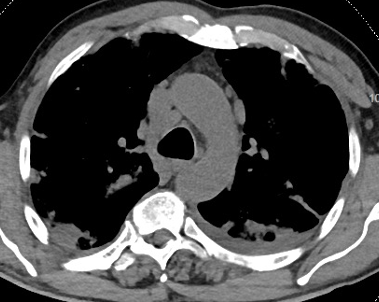
Figura 10. Scansione assiale TC che mostra linfoadenomegalie mediastiniche. Si associano aree consolidative a carico di entrambi i polmoni e piccola falda di versamento pleurico sinistro.
Noduli. Un nodulo polmonare per definizione è una opacità parenchimale rotondeggiante, o irregolare, delle dimensioni massime inferiori ai 3 cm ; spesso i noduli sono descritti in relazione a polmoniti virali. Nello specifico, la presenza di noduli solidi multipli irregolari viene riportata nel 3-13% dei pazienti affetti da COVID-19, talvolta in associazione a “halo sign”.
“Halo sign” e segno dell’atollo (o “reversed halo sign”). Con “halo sign” ci si riferisce ad un nodulo o ad una massa circondata da un’area “a vetro smerigliato” (Figura 11). L’”halo sign” è stato riportato solo in pochi casi di infezione polmonare da COVID-19 e non viene considerato un segno specifico per questa patologia. Il meccanismo patologico principale, responsabile del segno non è chiaro; si associa a infezioni fungine angio-invasive o a metastasi ipervascolari, come un possibile segno di emorragia, a infezioni virali ed a polmonite organizzativa. Specularmente, con segno dell’atollo (o “reversed halo sign”) ci si riferisce ad un’area di consolidazione ad anello con sovrapposizione di un’area ovalare “a vetro smerigliato”. In precedenza, questo segno è stato riportato in relazione alla presenza di polmonite organizzativa criptogenetica e ad altre infezioni polmonari. E stato, inoltre, riportato il segno dell’atollo nel 3,8% dei casi e dell’halo sign nel 17,6% dei pazienti affetti da COVID-19; entrambi i segni non sono stati osservati in associazione, come invece segnalato nella SARS e nella MERS.
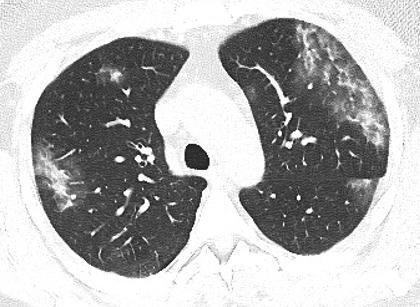
Figura 11. Scansione assiale TC che mostra aree di iperdensità parenchimale di tipo “a vetro smerigliato”, con iniziali aspetti consolidativi, a carico di entrambi i lobi polmonari superiori. A carico del lobo polmonare superiore destro in sede anteriore si apprezza piccola immagine nodulare con area ”a vetro smerigliato” limitrofa ( “halo sign” ).
Linfoadenopatie. Un linfonodo mediastinico si definisce linfoadeopatia quando presenta l’asse corto maggiore 1 cm (Figura 10). Questo reperto è stato riportato nel 4-8% dei pazienti affetti da COVID-19 ed è stato indicato come un possibile fattore di rischio significativo nei pazienti severi/critici affetti da COVD-19. Nel caso in cui la presenza di linfadenopatie si associ a versamento pleurico e a piccoli noduli parenchimali è imperativo sospettare la presenza di una sovra-infezione batterica.
Versamento pericardico. Il versamento pericardico viene riportato all’incirca nel 5% dei pazienti affetti da COVID-19 e si presume essere in relazione alla presenza di una infiammazione di grado severo (Figura 12).
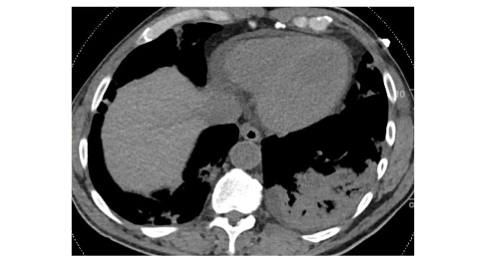
Figura 12. Scansione assiale TC che mostra falda di versamento pericardico. Estesa area consolidativa, con broncogramma aereo nel contesto è apprezzabile alla base polmonare di sinistra, con associato minimo versamento pleurico omolaterale. Piccole aree consolidative sono apprezzabili al polmone destro.
Diagnosi differenziale
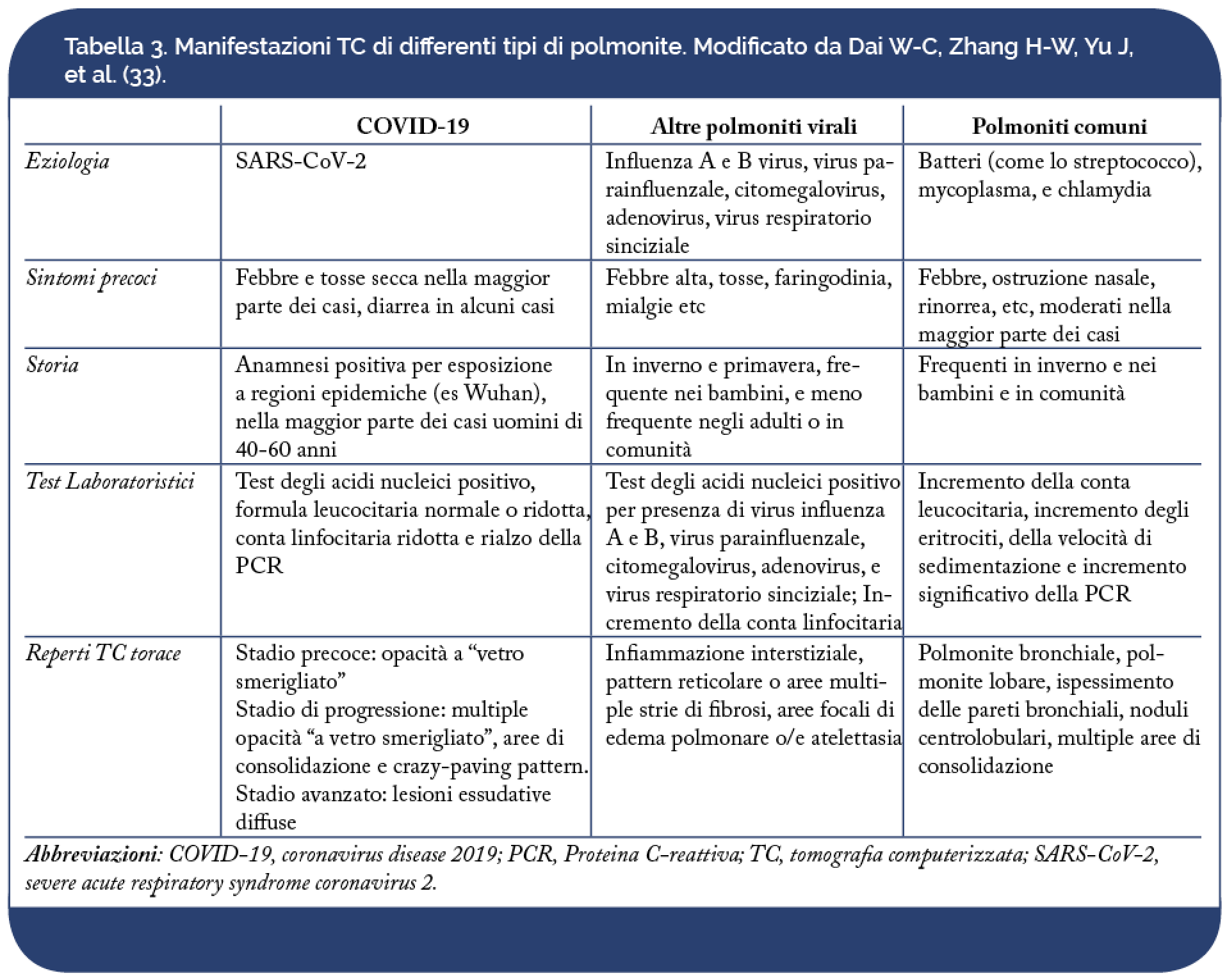
Posto il test RT-PCR come gold-standard per la diagnosi di COVID-19, la TC mantiene un ruolo cardine per la gestione e la diagnosi dei pazienti con sospetto elevato di COVID-19. Il test RT-PCR richiede un certo tempo e presenta una sensibilità limitata (inferiore alla TC negli stadi iniziali della infezione). Nel contesto di una emergenza epidemica, si rende necessario uno strumento che consenta una decisione rapida della gestione del paziente e la TC potrebbe parzialmente sopperire ai limiti intrinseci della RT-PCR. E’ tuttavia riportato che, utilizzando la RT-PCR come gold-standard, la TC mostra una sensibilità elevata (97%), ma una bassa specificità (25%) per la diagnosi di COVID-19. Pertanto, considerando il contesto stagionale-influenzale, occorre prestare particolare attenzione nel porre diagnosi differenziale con altre cause di polmonite, specialmente ad eziologia virale (Tabella 3).
Dato che la TC può consentire una precoce identificazione, permette di valutare rapidamente eventuali segni di progressione di malattia o di sviluppo di complicanze, il radiologo deve diventare confidente con i diversi pattern di manifestazioni e decorso di COVID-19. A differenza delle altre polmoniti, in TC la polmonite da SAR-CoV-2 raramente, presenta una distribuzione diffusa, versamento pleurico o linfoadenopatie, e caratteristicamente si manifesta con multiple opacità “a vetro smerigliato” bilaterali con distribuzione prevalentemente periferica, spesso associate ad aree di consolidazione e di ispessimento interstiziale. È interessante notare che la polmonite da SARS-CoV-2 presenti reperti radiologici in comune con la SARS e MERS, come le opacità “a vetro smerigliato” e le aree di consolidazione. Tale rilievo potrebbe essere in relazione ad una risposta stereotipata del polmone al danno: le opacità “a vetro smerigliato” sono un reperto acuto che gradualmente evolve e si organizza in un pattern lineare con distribuzione prevalentemente sub-pleurica e che eventualmente può presentare il “crazy-paving pattern” o il segno dell’atollo. Tuttavia, SARS e MERS, solitamente, dimostrano un coinvolgimento focale e non sono state descritte in associazione con il segno dell’atollo né tantomeno con l’halo sign. Inoltre, né la SARS né la MERS, come anche il COVID-19, dimostrano una associazione significativa con le linfoadenopatie, il versamento pleurico, i noduli e le cavitazioni.
Iter diagnostico: strategie di imaging
La strategia di imaging ottimale è attualmente ancora incerta. L’elemento discriminante per cui un paziente con sospetto COVID-19 viene ricoverato in ospedale o rimandato a domicilio è la presenza di una insufficienza respiratoria, secondaria al coinvolgimento polmonare infiammatorio. Le informazioni sul piano funzionale sono facilmente desumibili dall’emogasanalisi (procedura semplice, rapida e che non necessita dell’accesso del paziente a percorsi ospedalieri con rischi di contagi ulteriori) o dal test del cammino dei 6 minuti, mentre il dato anatomico-morfologico è legato all’esecuzione di indagini di imaging (procedure che tuttavia richiedono il percorso del paziente all’interno dell’ospedale con esposizione al virus di altro personale ed altri ambienti). Il primo step dell’iter diagnostico della COVID-19 resta, pertanto, un’accurata anamnesi epidemiologica che indaghi la storia di esposizione del paziente nelle due settimane precedenti a contati con persone provenienti da zone coinvolte dall’epidemia. La diagnosi finale viene posta mediante RT-PCR (Real Time – Polymerase Chain Reaction) su campioni di sangue o respiratori (Rubin GD, et al. Radiology, 2020). Va, tuttavia, considerato che pur rimanendo lo standard di riferimento per la diagnosi conclusiva di COVID-19, la RT-PCR su campione sanguigno o respiratorio può avere dei falsi negativi, dovuti ad errori di campionamento o alla bassa carica virale (Rubin GD, et al. Radiology, 2020). Alcuni studi hanno, inoltre, dimostrato una ridotta sensibilità nei primi 5 giorni di malattia (Ai R, et al. Radiology: Cardiothoracic Imaging, 2020). E’ stato, infatti, dimostrato che reperti indicativi di coinvolgimento polmonare erano presenti al primo esame TCAR nel 98% dei casi infetti, rispetto alla prima RT-PCR, che era risultata positiva solo nel 71% di questi. Sulla base di tali evidenze e la situazione di grave emergenza, la Commissione di Salute Pubblica Cinese ha “incoraggiato” la diagnosi basata sui dati clinici e radiologici all’esame TC nelle aree “rosse” (Li Y, et al. American J of Roentgenology, 2020, Zhao W, et al. American Journal of Roentgenology, 2020, Liu J, et al. European Journal of Nuclear Medicine and Molecular Imaging, 2020), nonostante le raccomandazioni dell’OMS. La TC riveste un ruolo importante nel management del paziente e nella scelta terapeutica.
Valutazione della severità del coinvolgimento polmonare in TCAR: metodi di scoring
La valutazione quantitativa delle alterazioni TCAR nei pazienti con interstiziopatia polmonare è tuttora piuttosto complessa e problematica, soprattutto nei pazienti con fibrosi polmonari idiopatica (IPF) (Wong AW, et al CHEST Journal. 2020). Nonostante ci siano stati diversi studi che negli anni che hanno quantificato con score visivo le alterazioni TC al basale e durante il follow-up, valutando l’impatto prognostico dei cambiamenti di tali alterazioni durante il follow-up, i risultati non sono stati molto promettenti. La principale spiegazione di questo è che la valutazione quantitativa della TC è soggettiva e la concordanza tra lettori è bassa nella valutazione delle principali alterazioni TC e influenzata dall’esperienza del lettore stesso e pertanto scarsamente riproducibile. Queste limitazioni hanno spinto la ricerca verso una valutazione oggettiva di tali alterazioni attraverso strumenti di analisi dell’imaging basati su tecniche computerizzate per valutare l’entità e la progressione della malattia alla TC. L’istogramma delle attenuazioni TC, che riflette la densità del polmone, può essere utilizzato per caratterizzare e quantificare la malattia polmonare diffusa. Diversi studi hanno valutato le misure basate sull’istogramma come indice dell’attenuazione del polmone dalle immagini TC nei pazienti con IPF e hanno dimostrato una correlazione con i marcatori fisiologici di gravità della malattia. Una limitazione dell’analisi dell’istogramma è che questo usa una sola funzione per valutare la malattia polmonare diffusa: la densità del polmone. Nell’ambito delle malattie miste, come l’enfisema associato a la fibrosi una valutazione discriminatoria non è possibile, utilizzando queste tecniche. Viceversa, l’analisi strutturale comporta l’identificazione di diversi modelli di alterazioni TCAR (honeycombing, reticolazione o l’aspetto a “vetro smerigliato”) utilizzando più funzioni di struttura, determinate dai dati TC.
Lo score di severità, utilizzato nella nostra esperienza, prevede la valutazione separata dell’estensione e della natura dei reperti TCAR. Ciascuno score, quello di estensione e quello della natura delle lesioni, è compreso fra 0 e 4 ed i livelli da valutare sono 3 per ciascun polmone. Per ciascun livello lo score di estensione viene moltiplicato per quello della natura delle lesioni. I punteggi ottenuti per ciascun polmone vengono sommati per ottenere lo score totale di severità (compreso da 0 a 96) (Figura 13).
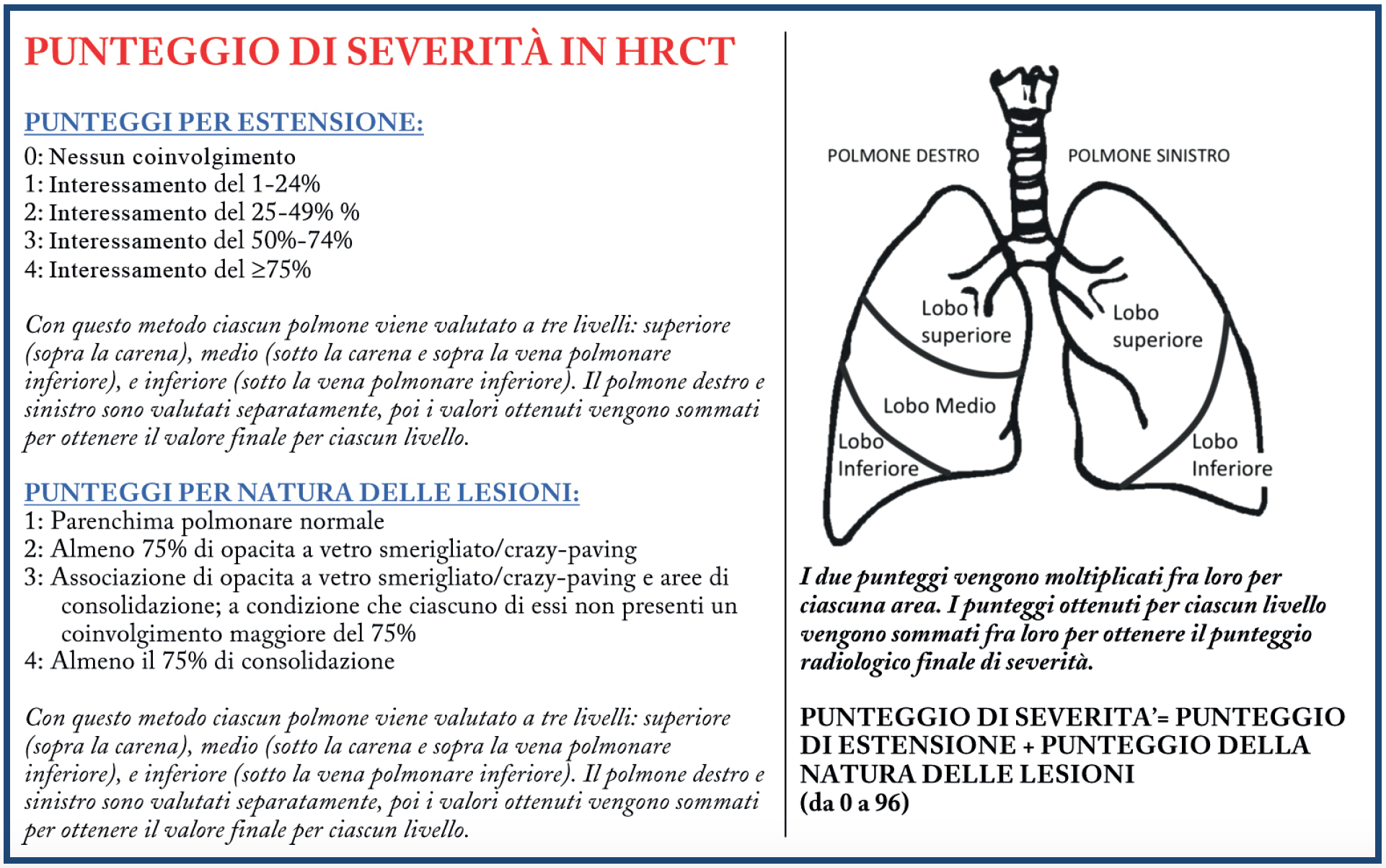
Figura 13. Score di severità in TCAR per la valutazione della estensione e della natura delle lesioni parenchimali in corso di infezione polmonare da COVID-19
Conclusioni
In conclusione, la diagnosi di COVID-19 dovrebbe basarsi sulla combinazione di dati epidemiologici, clinici e radiologici, e sui risultati del test RT-PCR, considerato il gold-standard diagnostico. I reperti radiologici di più comune riscontro in TCAR, per quanto aspecifici, sono rappresentati dalle aree a “vetro smerigliato” multifocali, bilaterali, associate ad aree di consolidazione con distribuzione a chiazze, prevalentemente periferiche/subpleuriche e con maggior coinvolgimento delle regioni posteriori e dei lobi inferiori. Il riconoscimento da parte del medico radiologo delle caratteristiche più peculiari all’imaging TCAR della polmonite COVID-19 è di cruciale importanza nella identificazione precoce dell’infezione, nella valutazione della severità di malattia e nella corretta interpretazione delle modificazioni temporali del quadro radiologico, durante il follow-up, fino alla risoluzione definitiva. In tale contesto, l’imaging TCAR svolge un ruolo anche nella identificazione di eventuali casi di non completa risoluzione o di possibili re-infezioni. La TCAR, pertanto, non riveste un ruolo definito nella fase iniziale e forse neppure finale del processo morboso, quanto piuttosto nella fase intermedia del percorso diagnostico del paziente, per comprendere quanto sia necessario essere tempestivi, aggressivi e terapeuticamente impattanti. Anche l’American College of Radiology sostiene che la TCAR non dovrebbe essere impiegata come tecnica di screening, né come metodica di prima linea, ma solamente ne pazienti ospedalizzati, sintomatici o con specifiche indicazioni cliniche (Rubin GD, et al. Radiology, 2020, American College of Radiology (ACR). 2020).
Punti chiave
- COVID-19 è un’emergenza sanitaria esplosa in Italia dal 21 febbraio 2020 che ha richiesto alle Istituzioni Sanitarie uno sforzo organizzativo urgente, in relazione alle pesanti implicazioni cliniche ed alle imprevedibili ripercussioni sulla sanità pubblica che ha comportato.
- I pazienti con infezione da COVID-19, possono presentare diversi fenotipi clinici, che variano dall’infezione asintomatica, all’ARDS sino allo shock settico. Il più frequente grave quadro clinico risulta essere la polmonite virale, caratterizzata da febbre, tosse, dispnea e quadro radiologico con infiltrati bilaterali.
- In un contesto di sintomatologia aspecifica e di quadri clinici estremamente variabili come gravità e progressione, il contributo dell’imaging può essere utile nel valutare il decorso e la severità della malattia, e quindi nell’orientare il management clinico del paziente.
- L’esame radiografico standard del torace è gravato da una bassa sensibilità nell’identificazione delle precoci alterazioni polmonari. Di contro, la TC del torace ad alta risoluzione (TCAR) è la metodica di scelta nello studio della polmonite da COVID-19.
- Sulla base delle evidenze scientifiche finora acquisite, considerando l’aspecificità dei segni e dei pattern TCAR della polmonite da COVID-19, che non consentono di esprimere un giudizio diagnostico di certezza, l’esame TCAR del torace non può essere considerato sostitutivo del test RT-PCR nella diagnosi di COVID-19, né tantomeno utilizzato come mezzo di screening clinico.
Bibliografia
- Luo CM, Wang N, Yang XL, Liu HZ, Zhang W, Li B, Hu B, Peng C, Geng QB, Zhu GJ, Li F, Shi ZL. Discovery of Novel Bat Coronaviruses in South China That Use the Same Receptor as Middle East Respiratory Syndrome Coronavirus. J Virol. 2018, 13;92(13). pii: e00116-18.
- Almeida JD, Cunningham CH, Dowdle WR, Hofstad MS, McIntosh K, Tajima M, Zakstelskaya LY, Easterday BC, Kapikian A, Bingham RW. Intervirology. 1975;5(1-2):76-82.
- Cui J, Li F, Shi ZL. Origin and evolution of pathogenic coronaviruses. Nat Rev Microbiol. 2019;17(3):181-192.
- Song Z, Xu Y, Bao L, Zhang L, Yu P, Qu Y, Zhu H, Zhao W, Han Y, Qin C. From SARS to MERS, Thrusting Coronaviruses into the Spotlight. 2019, 14;11(1). pii: E59.
- Wang Y, Wang Y, Chen Y, Qin Q. Unique epidemiological and clinical features of the emerging 2019 novel coronavirus pneumonia (COVID-19) implicate special control measures. J Med Virol. 2020 Mar 5.
- Rothan HA, Byrareddy SN. The epidemiology and pathogenesis of coronavirus disease (COVID-19) outbreak. J Autoimmun. 2020 May;109:102433.
- Kolifarhood G, Aghaali M, Mozafar Saadati H, Taherpour N, Rahimi S, Izadi N, Hashemi Nazari SS. Epidemiological and Clinical Aspects of COVID-19; a Narrative Arch Acad Emerg Med. 2020,1;8(1):e41. eCollection 2020.
- Lai CC, Shih TP, Ko WC, Tang HJ, Hsueh PR. Severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) and coronavirus disease-2019 (COVID-19): The epidemic and the challenges. Int J Antimicrob Agents. 2020;55(3):105924.
- Sorbello M, El-Boghdadly K, Di Giacinto I, Cataldo R, Esposito C, Falcetta S, Merli G, Cortese G, Corso RM, Bressan F, Pintaudi S, Greif R, Donati A, Petrini F; Società Italiana di Anestesia Analgesia Rianimazione e Terapia Intensiva (SIAARTI) Airway Research Group, and The European Airway Management Society. The Italian coronavirus disease 2019 outbreak: recommendations from clinical practice. Anaesthesia. 2020 Mar 27.
- Yao W, Wang T, Jiang B, Gao F, Wang L, Zheng H, Xiao W, Yao S, Mei W, Chen X, Luo A, Sun L, Cook T, Behringer E, Huitink JM, Wong DT, Lane-Fall M, McNarry AF, McGuire B, Higgs A, Shah A, Patel A, Zuo M, Ma W, Xue Z, Zhang LM, Li W, Wang Y, Hagberg C, O’Sullivan EP, Fleisher LA, Wei H; collaborators. Emergency tracheal intubation in 202 patients with COVID-19 in Wuhan, China: lessons learnt and international expert recommendations. Br J Anaesth. 2020 Apr 10. pii: S0007-0912(20)30203-8.
- Giamarellos-Bourboulis EJ, Netea MG, Rovina N, Akinosoglou K, Antoniadou A, Antonakos N, Damoraki G, Gkavogianni T, Adami ME, Katsaounou P, Ntaganou M, Kyriakopoulou M, Dimopoulos G, Koutsodimitropoulos I, Velissaris D, Koufargyris P, Karageorgos A, Katrini K, Lekakis V, Lupse M, Kotsaki A, Renieris G, Theodoulou D, Panou V, Koukaki E, Koulouris N, Gogos C, Koutsoukou A. Complex Immune Dysregulation in COVID-19 Patients with Severe Respiratory Failure. Cell Host Microbe. 2020 Apr 17. pii: S1931-3128(20)30236-5.
- Deftereos SG, Siasos G, Giannopoulos G, Vrachatis DA, Angelidis C, Giotaki SG, Gargalianos P, Giamarellou H, Gogos C, Daikos G, Lazanas M, Lagiou P, Saroglou G, Sipsas N, Tsiodras S, Chatzigeorgiou D, Moussas N, Kotanidou A, Koulouris N, Oikonomou E, Kaoukis A, Kossyvakis C, Raisakis K, Fountoulaki K, Comis M, Tsiachris D, Sarri E, Theodorakis A, Martinez-Dolz L, Sanz-Sánchez J, Reimers B, Stefanini GG, Cleman M, Filippou D, Olympios CD, Pyrgakis VN, Goudevenos J, Hahalis G, Kolettis TM, Iliodromitis E, Tousoulis D, Stefanadis C. The Greek study in the effects of colchicine in COvid-19 complications prevention (GRECCO-19 study): Rationale and study design. Hellenic J Cardiol. 2020 Apr 3. pii: S1109-9666(20)30061-0. doi:
- Huang C, Wang Y, Li X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet 2020; 395(10223): 497-506.
- Chen N, Zhou M, Dong X, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet 2020; 395(10223): 507-13.
- Wu Z, McGoogan JM. Characteristics of and Important Lessons From the Coronavirus Disease 2019 (COVID-19) Outbreak in China: Summary of a Report of 72 314 Cases From the Chinese Center for Disease Control and Prevention. JAMA. 2020 Feb 24.
- Wang D, Hu B, Hu C, Zhu F, Liu X, Zhang J, Wang B, Xiang H, Cheng Z, Xiong Y, Zhao Y, Li Y, Wang X, Peng Z. Clinical Characteristics of 138 Hospitalized Patients With 2019 Novel Coronavirus-Infected Pneumonia in Wuhan, China. JAMA. 2020 Feb 7.
- Zhonghua Liu Xing Bing Xue Za Zhi. Novel Coronavirus Pneumonia Emergency Response Epidemiology Team. The epidemiological characteristics of an outbreak of 2019 novel coronavirus diseases (COVID-19) in China]. 2020 Feb 17;41(2):145-151.
- Wei M, Yuan J, Liu Y, Fu T, Yu X, Zhang ZJ. Novel Coronavirus Infection in Hospitalized Infants Under 1 Year of Age in China. 2020 Feb 14.
- Chen F, Liu ZS, Zhang FR, et al. First case of severe childhood novel coronavirus pneumonia in China. Zhonghua Er Ke Za Zhi 2020; 58(0): E005.
- Fu L, Wang B, Yuan T, Chen X, Ao Y, Fitzpatrick T, Li P, Zhou Y, Lin YF, Duan Q, Luo G, Fan S, Lu Y, Feng A, Zhan Y, Liang B, Cai W, Zhang L, Du X, Li L, Shu Y, Zou H. Clinical characteristics of coronavirus disease 2019 (COVID-19) in China: A systematic review and meta-analysis. J Infect. 2020 Apr 10. pii:S0163-4453(20)30170-5.
- Misra DP, Agarwal V, Gasparyan AY, Zimba O. Rheumatologists’ perspective on coronavirus disease 19 (COVID-19) and potential therapeutic targets, 2020;1–8.
- Choi H, Qi X, Yoon S H, Park SJ, Lee KH, Kim JY, et al. Extension of Coronavirus Disease 2019 (COVID-19) on Chest CT and Implications for Chest Radiograph Interpretation. Radiology: Cardiothoracic Imaging, 20120; 2(2), e200107–30.
- Yoon SH, Lee KH, Kim JY, Lee YK, Ko H, Kim KH, et al. Chest Radiographic and CT Findings of the 2019 Novel Coronavirus Disease (COVID-19): Analysis of Nine Patients Treated in Korea. Korean Journal of Radiology, 2020;21, 1–7.
- Ng MY, Lee E.Y, Yang J, Yang F, Li X, Wang H, et al. Imaging Profile of the COVID-19 Infection: Radiologic Findings and Literature Review. Radiology: Cardiothoracic Imaging, 2010;2(1), e200034.
- Yang, W., Sirajuddin, A., Zhang, X., Liu, G., Teng, Z., Zhao, S., & Lu, M. (2020). The role of imaging in 2019 novel coronavirus pneumonia (COVID-19), 1–9.
- Bernheim A, Mei X, Huang M, Yang Y, Fayad ZA, Zhang N, Diao K, Lin B, Zhu X, Li K, Li S, Shan H, Jacobi A, Chung M. Chest CT Findings in Coronavirus Disease-19 (COVID-19): Relationship to duration of Infection. Radiology. 2020 Feb 20:200463.
- Wong HYF, Lam HYS, Fong AHT, Leung ST, Chin TWY, Lo CSY, et al. Frequency and Distribution of Chest Radiographic Findings in COVID-19 Positive Patients. Radiology, 2020;2(2), 201160–23.
- Pan F, Ye T, Sun P, Gui S, Liang B, Li L, et al. (2020). Time Course of Lung Changes On Chest CT During Recovery From 2019 Novel Coronavirus (COVID-19) Pneumonia. Radiology, 200370.
- Shi H, Han X, Jiang N, Cao Y, Alwalid O, Gu, J., et al. (2020). Radiological findings from 81 patients with COVID-19 pneumonia in Wuhan, China: a descriptive study. The Lancet Infectious Diseases.
- Caruso D, Zerunian M, Polici M, Pucciarelli F, Polidori T, Rucci C, et al. Chest CT Features of COVID-19 in Rome, Italy. Radiology, 2020;201237–17.
- Oudkerk M, Büller HR, Kuijpers D, van Es N, Oudkerk SF, McLoud TC, et al. Diagnosis, Prevention, and Treatment of Thromboembolic Complications in COVID-19: Report of the National Institute for Public Health of the Netherlands. Radiology, 2020;201629.
- Guan CS, Lv ZB, Yan S, Du YN, Chen H, Wei LG, et al. Imaging Features of Coronavirus disease 2019 (COVID-19): Evaluation on Thin-Section CT. Academic Radiology, 2020; 27(5), 609–613.
- Dai W-C, Zhang H-W, Yu J, et al (2020) CT Imaging and Differential Diagnosis of COVID-19. Can Assoc Radiol 3:846537120913033.
- Rubin GD, Haramati LB, Kanne JP, Schluger NW, Yim JJ., Anderson DJ, et al.The Role of Chest Imaging in Patient Management during the COVID-19 Pandemic: A Multinational Consensus Statement from the Fleischner Society. Radiology, 2020;201365–24.
- Ai R, Simpson S, Kay FU, Abbara S, Bhalla S, Chung JH, Chung M, et al. Radiological Society of North America Expert Consensus Statement on Reporting Chest CT Findings Related to COVID-19. Endorsed by the Society of Thoracic Radiology, the American College of Radiology, and RSNA. Radiology: Cardiothoracic Imaging, 2020; 2(2), e200152–24.
- Li Y, Xia L. Coronavirus Disease 2019 (COVID-19): Role of Chest CT in Diagnosis and Management. American Journal of Roentgenology, 2020;1–7.
- Zhao W, Zhong Z, Xie X, Yu Q, Liu J. Relation Between Chest CT Findings and Clinical Conditions of Coronavirus Disease (COVID-19) Pneumonia: A Multicenter Study. American Journal of Roentgenology, 2020;1–6.
- Liu J, Yu H, Zhang S. The indispensable role of chest CT in the detection of coronavirus disease 2019 (COVID-19). European Journal of Nuclear Medicine and Molecular Imaging, 2020;1–2.
- Wong AW, Fidler L, Marcoux V, Johannson KA, Assayag D, Fisher JH, et al.Practical considerations for the diagnosis and treatment of fibrotic interstitial lung disease during the COVID-19 pandemic. CHEST Journal. 2020.
- Rubin GD, Haramati LB, Kanne JP, Schluger NW, Yim JJ, Anderson DJ, et al.The Role of Chest Imaging in Patient Management during the COVID-19 Pandemic: A Multinational Consensus Statement from the Fleischner Society. Radiology, 2020;201365–24.
- American College of Radiology (ACR). ACR Recommendations for the use of Chest Radiography and Computed Tomography (CT) for Suspected COVID-19 Infection. Retrieved April 26, 2020, from https://www.acr.org/Advocacy-and-Economics/ACR-Position-Statements/Recommendations-for-Chest-Radiography-and-CT-for-Suspected-COVID19-Infection
